Alteración de la entropía en la precuña y la corteza cingulada posterior en la enfermedad de Alzheimer: estudio de resonancia magnética funcional en reposo
Alteration of Entropy in the Precuneus and Posterior Cingulate Cortex in Alzheimer’s Disease: A Resting-State Functional Magnetic Resonance Study
Recibido: 09 agosto 2021
Aceptado: 23 noviembre 2021
Disponible: 16 noviembre 20211
A. C. Puche; J. F. Ochoa-Gómez; Y. A. Agudelo-Londoño; J. K. Rodas-Marín; C. A. Tobón-Quintero, “Alteración de la entropía en la precuña y la corteza cingulada posterior en la enfermedad de Alzheimer: estudio de resonancia magnética funcional en reposo”, TecnoLógicas, vol. 24, nro. 52, e2118, 2021. https://doi.org/10.22430/22565337.2118
Resumen
El cerebro humano ha sido descrito como un sistema complejo. Su estudio por medio de señales neurofisiológicas ha desvelado la presencia de interacciones lineales y no lineales. En este contexto, se han utilizado métricas de entropía para descubrir el comportamiento cerebral en presencia y ausencia de alteraciones neurológicas. El mapeo de la entropía es de gran interés para el estudio de enfermedades neurodegenerativas progresivas como la enfermedad de Alzheimer. El objetivo de este estudio fue caracterizar la dinámica de las oscilaciones cerebrales en dicha enfermedad por medio de la entropía y la amplitud de las oscilaciones de baja frecuencia a partir de señales Bold de la red por defecto y la red de control ejecutivo en pacientes con Alzheimer e individuos sanos, utilizando una base de datos extraída de la serie de estudios de imágenes de acceso abierto. Los resultados revelaron mayor poder discriminatorio de la entropía por permutaciones en comparación a la amplitud de fluctuación de baja frecuencia y la amplitud fraccional de fluctuaciones de baja frecuencia. Se obtuvo un incremento de la entropía por permutaciones en regiones de la red por defecto y la red de control ejecutivo en pacientes. La corteza cingulada posterior y la precuña manifestaron característica diferencial al evaluar la entropía por permutaciones en ambos grupos. No hubo hallazgos al correlacionar las métricas con las escalas clínicas. Los resultados demostraron que la entropía por permutaciones permite caracterizar la función cerebral en pacientes con Alzheimer, además revela información sobre las interacciones no lineales complementaria a las características obtenidas por medio del cálculo de la amplitud de las oscilaciones de baja frecuencia.
Palabras clave: Resonancia magnética funcional, enfermedad de Alzheimer, entropía por permutaciones, red por defecto, red de control ejecutivo.
Abstract
The human brain has been described as a complex system. Its study using neurophysiological signals has revealed the presence of linear and non-linear interactions. In this context, entropy metrics have been used to discover brain behavior in the presence and absence of neurological alterations. Entropy mapping is of great interest for the study of progressive neurodegenerative diseases such as Alzheimer’s Disease (AD). The objective of this study was to characterize the dynamics of brain oscillations in AD using entropy and the Amplitude of Low-Frequency Fluctuations (ALFF) of BOLD signals from the default network and the executive control network in patients with AD and healthy individuals. For this purpose, the data was extracted from the Open Access Series of Imaging Studies (OASIS). The results revealed greater discriminatory power in Permutation Entropy (PE) than in ALFF and fractional ALFF metrics. An increase in PE was obtained in regions of the default network and the executive control network in patients. The posterior cingulate cortex and the precuneus exhibited a differential characteristic when PE was evaluated in both groups. There were no findings when the metrics were correlated with clinical scales. The results showed that PE can be used to characterize the brain function in patients with AD and reveals information about non-linear interactions complementary to the characteristics obtained by calculating the ALFF.
Keywords: Functional magnetic resonance imaging, Alzheimer’s disease, Permutation entropy, Medical image processing, Default mode network, Executive network.
1. INTRODUCCIÓN
La enfermedad de Alzheimer (EA) es la causa más común de demencia [
Distintas modalidades de imágenes han sido ampliamente usadas para el estudio de la EA. En particular, la resonancia magnética funcional es considerada una tecnología que podría tener relevancia clínica debido a su prometedor potencial para la identificación de alteraciones cerebrales causadas por la enfermedad [
El uso de métricas de conectividad basadas en teoría de grafos y el análisis de componentes independientes ha permitido identificar un deterioro acelerado en sujetos con EA en regiones específicas del cerebro, como es el caso de las áreas involucradas en la red por defecto, mientras que en sujetos con envejecimiento normal se han identificado disrupciones con ocurrencia no uniformemente en todo el cerebro [
A pesar de que la rs-fMRI ha arrojado información relacionada con la dinámica cerebral, aún no es una técnica usualmente utilizada en entornos clínicos debido a factores como la presencia de artefactos en las señales y la ausencia de métricas de referencia (gold standard) para la estimación de la función cerebral [
Varios enfoques se han utilizado para estimar la complejidad cerebral por medio de métricas no lineales, dentro de ellas se encuentra una variedad de enfoques para el cálculo de la entropía [
En este estudio se utilizaron datos de rs-fMRI con 164 puntos de tiempo de la iniciativa de acceso abierto OASIS-3 (en inglés: Open Access Series of Imaging Studies: Longitudinal MRI Data in Non-demented and Demented Older Adults) [
2. METODOLOGÍA
2.1 Sujetos
Datos de resonancia magnética estructural y resonancia magnética funcional etiquetados como EA y CN fueron descargados de la base de datos OASIS-3 [
Luego de realizar la revisión clínica, se preprocesaron datos de 117 sujetos, de los cuales 23 fueron descartados por exceso de movimiento (EA: 12, CN:11) y 1 sujeto del grupo CN fue descartado por tener valores atípicos en varias regiones de la red por defecto. Finalmente se incluyeron datos de 93 sujetos (EA: 36, CN:57) para los análisis posteriores. Si bien la base de datos no proporciona específicamente información sobre la gravedad de la enfermedad, esta se determinó por la suma de cajas de la escala de valoración clínica de la demencia (CDR-SB, por sus siglas en inglés: Dementia Rating Scale Sum of Boxes) y la escala Mini Mental (MMSE, por sus siglas en inglés: Mini-Mental State Examination). Dado que los individuos del grupo EA están caracterizados por un 4.5 < CDR-SB < 9 pertenecen a la categoría Alzheimer leve [
| Parámetro | EA Media ± Desviación estándar | CN Media ± Desviación estándar | Valor p |
| n | 36 | 57 | - |
| Sexo (femenino: masculino) | 16:20 | 24:33 | 0.48 |
| Edad | 74.70 ± 5.89 | 70.97 ± 6.52 | <0.01 |
| Escolaridad (años) | 15.33 ± 2.77 | 15.68 ± 2.70 | 0.72 |
| MMSE | 25.19 ± 3.14 | 28.91 ± 1.24 | <0.01 |
| CDR-SB | 3.33 ± 1.45 | 0.00 ± 0.00 | <0.01 |
2.2 Adquisición de las imágenes
Las imágenes de rs-fMRI fueron adquiridas con un escáner SIEMENS 3T (MAGNETOM Trio Tim, Siemens, Erlangen, Germany). Se adquirieron 164 volúmenes de 36 cortes cada uno y tamaño de voxel de 4x4x4 mm con los parámetros: tiempo eco (TE) = 27 ms, tiempo de repetición (TR) = 2200 ms, ángulo de giro (FA) = 90°, tamaño de la matriz = 64. Información adicional relacionada con la adquisición de las imágenes se puede encontrar en [
2.3 Procesamiento de las imágenes
El preprocesamiento de las imágenes fue realizado en la toolbox CONN [
Las imágenes de los 94 sujetos restantes fueron normalizadas al espacio estándar definido por el Instituto Neurológico de Montreal (MNI, por sus siglas en inglés: Montreal National Institute), conservando el tamaño de voxel 2x2x2 mm. Se realizó eliminación de tendencias de movimiento, señales relacionadas con la sustancia blanca y líquido cefalorraquídeo. Se aplicó un filtro pasa-banda en el rango de frecuencia de 0.01 Hz a 0.1 Hz.
2.4 Extracción de la señal BOLD
La extracción de las señales se realizó a partir de las plantillas propuestas por [
la plantilla de referencia. Fuente: elaboración propia.
| Etiqueta | Red por defecto | Etiqueta | Red de Control Ejecutivo |
| 1 | Corteza Prefrontal Medial, Corteza Cingulada Anterior y Corteza Orbitofrontal (B) | 1 | Giro Frontal Medio, Giro Frontal Superior (I) |
| 2 | Giro Angular (I) | 2 | Giro Frontal Inferior, Giro Orbitario Frontal (I) |
| 3 | Giro Frontal Superior (D) | 3 | Lóbulo Parietal Superior, Lóbulo Parietal Inferior, Precuña, Giro Angular (I) |
| 4 | Corteza Cingulada Posterior, Precuña (B) | 4 | Giro Temporal Inferior, Giro Temporal Medio (I) |
| 5 | Corteza Cingulada Anterior Dorsal (B) | 5 | Crus I (D) |
| 6 | Tálamo (B) | 6 | Giro Frontal Medio, Giro Frontal Superior (D) |
| 7 | Hipocampo (I) | 7 | Giro Frontal Medio (D) |
| 8 | Hipocampo (D) | 8 | Lóbulo Parietal Inferior, Giro Supramarginal, Giro Angular (D) |
| 9 | Corteza Retrospenial, Corteza Cingulada Posterior (I) | 9 | Giro Frontal Superior (D) |
| 10 | Giro Frontal Medio (I) | 10 | Crus I, Crus II, Lóbulo VI (D) |
| 11 | Giro Parahipocampal (I) | 11 | Núcleo Caudado (D) |
| 12 | Giro Occipital Medio (I) | - | - |
| 13 | Corteza Retrospenial, Corteza Cingulada Posterior (D) | - | - |
| 14 | Precuña (B) | - | - |
| 15 | Giro Frontal Superior, Giro Frontal Medio (D) | - | - |
| 16 | Giro Parahipocampal (D) | - | - |
| 17 | Giro Angular. Giro Occipital Medio (D) | - | - |
2.5 Análisis de la señal BOLD
Para cada región de la RD y la RCE se aplicaron las medidas espectrales: ALFF y fALFF y la métrica no lineal: entropía por permutaciones (PE, por sus siglas en inglés: Permutation Entropy). Todas las métricas fueron calculadas sobre las señales en la banda de frecuencia de 0.01 Hz a 0.1 Hz.
2.5.1 Amplitud de las fluctuaciones de baja frecuencia
La ALFF se define como la suma de amplitudes en una banda de frecuencia, mientras que la fALFF se define como la fracción de la suma de amplitudes en una banda de frecuencia. Para una serie de tiempo de longitud N definida en (1), el cálculo de las métricas ALFF y fALFF está representado por (2) y (3), respectivamente [
2.5.2 Entropía por permutaciones
La entropía por permutaciones es un enfoque propuesto por [
Para el cálculo de la EP se utilizó un retraso embebido (𝑙) de (2) y una dimensión embebida (𝑚) de (4) [
N = 164, corresponde a la longitud de la serie de tiempo. El parámetro 𝑙 no tiene mucha influencia en la entropía de la serie de tiempo, su valor se tomó con base en la literatura reportada por estudios de electroencefalografía [
2.5.3 Análisis estadístico
Se removió el efecto de la edad de las métricas por medio de una regresión lineal. Para la comparación entre grupos se utilizó una prueba estadística no paramétrica de dos muestras, descrita por [
Las métricas se llevaron al rango de 0 a 1 para mejorar la visualización de los resultados por medio de diagramas de cajas.
3. RESULTADOS
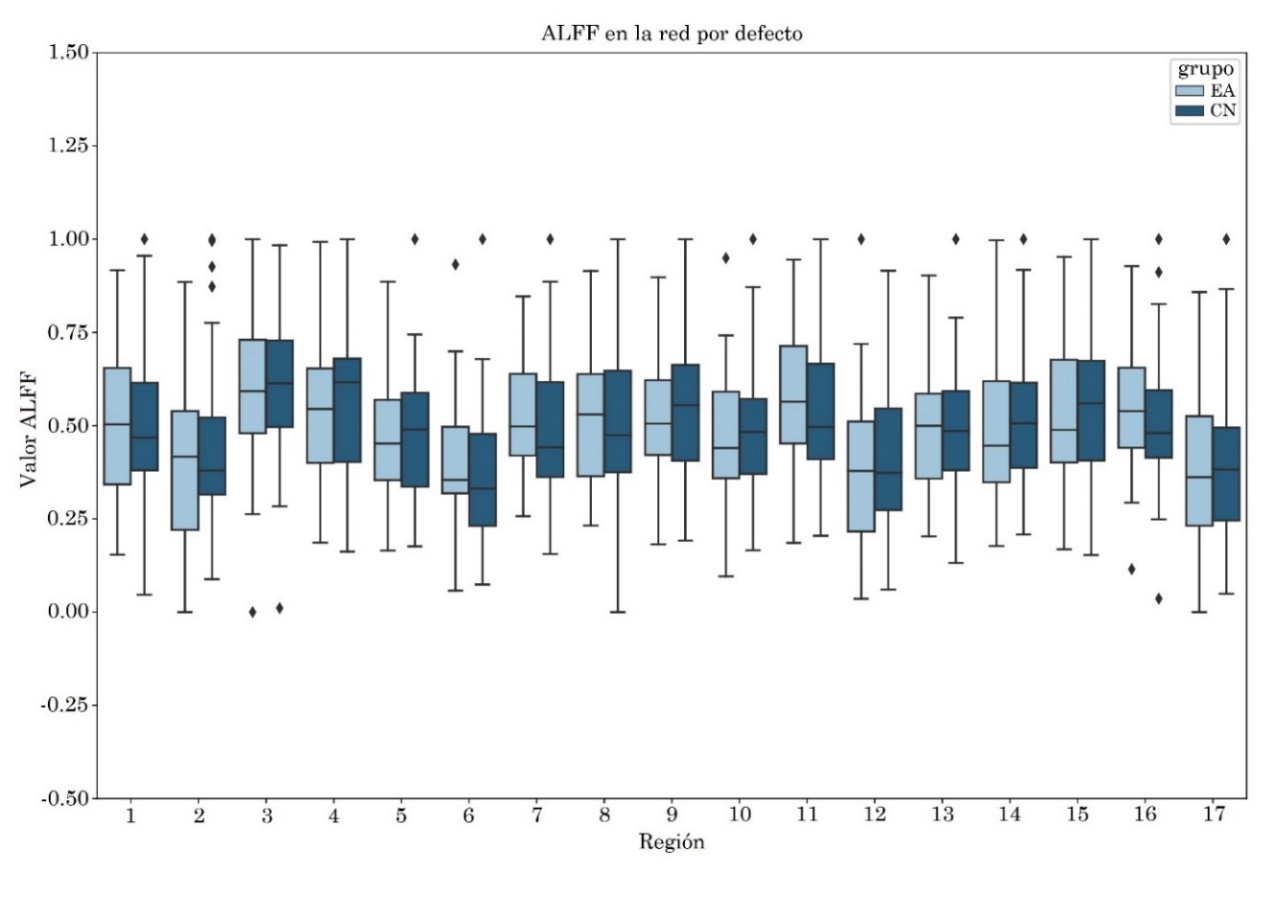
3.1 Red por defecto
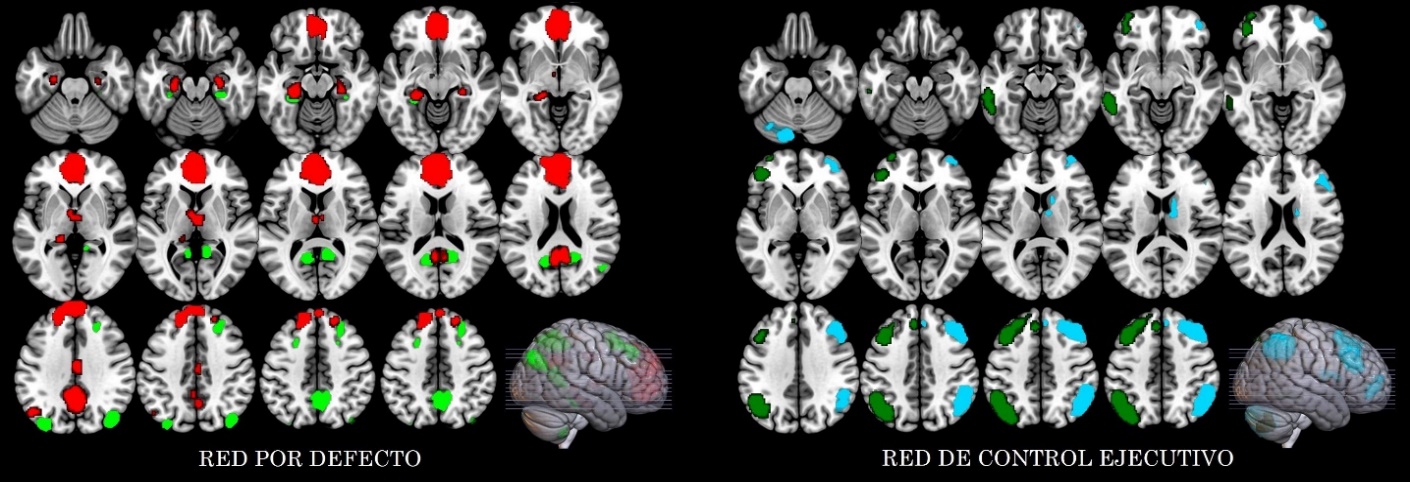
Se observó un incremento estadísticamente significativo en la entropía del grupo EA en comparación con el grupo CN en la región 10 que involucra a la corteza retrosplenial y la corteza cingulada posterior del hemisferio izquierdo, con tamaño del efecto mediano de valor -0.57. El incremento en la entropía también se pudo observar en la región 4, que involucra la corteza cingulada posterior y precuña, con tamaño del efecto mediano de valor -0.57 (Tabla 3 y Figura 2).
por defecto. Fuente: elaboración propia
| ROI | ALFF | fALFF | PE | ||||||
| p1_unc | p2_unc | ES | p1_unc | p2_unc | ES | p1_unc | p2_unc | ES | |
| 1 | .40 | .60 | -.01 | .43 | .57 | .05 | .21 | .79 | .15 |
| 2 | .29 | .71 | .08 | .09 | .91 | .16 | .08 | .92 | .35 |
| 3 | .47 | .53 | -.03 | .72 | .28 | -.08 | .54 | .46 | .01 |
| 4 | .47 | .53 | -.04 | .46 | .54 | -.07 | .99 | .01 | -.57 |
| 5 | .53 | .47 | -.05 | .77 | .23 | -.16 | .47 | .53 | .06 |
| 6 | .88 | .12 | -.29 | .70 | .30 | -.10 | .24 | .76 | .08 |
| 7 | .85 | .15 | -.32 | .45 | .55 | .03 | .08 | .92 | .37 |
| 8 | .50 | .50 | -.12 | .27 | .73 | .12 | .18 | .82 | .29 |
| 9 | .45 | .55 | -.02 | .51 | .49 | -.01 | 1.0 | .00* | -.57 |
| 10 | .40 | .60 | -.03 | .65 | .35 | -.12 | .59 | .41 | -.04 |
| 11 | .86 | .14 | -.28 | .77 | .23 | -.09 | .84 | .16 | -.19 |
| 12 | .26 | .74 | .09 | .36 | .64 | .07 | .16 | .84 | .26 |
| 13 | .59 | .41 | -.13 | .52 | .48 | -.04 | .81 | .19 | -.07 |
| 14 | .29 | .71 | .09 | .80 | .20 | -.25 | .87 | .13 | -.28 |
| 15 | .44 | .56 | -.07 | .53 | .47 | .00 | .87 | .13 | -.23 |
| 16 | .82 | .18 | -.25 | .83 | .17 | -.19 | .58 | .42 | .00 |
| 17 | .37 | .63 | .02 | .59 | .41 | -.12 | .55 | .45 | .06 |
p1_unc: valor-p no corregido para la cola CN > AD, p2_unc: valor-p no corregido
para la cola CN < AD, ES: tamaño del efecto, I: izquierdo, D: derecho, *: región con
p_fdr<0.05 (p1_fdr:1.0, p2_fdr:0.04).
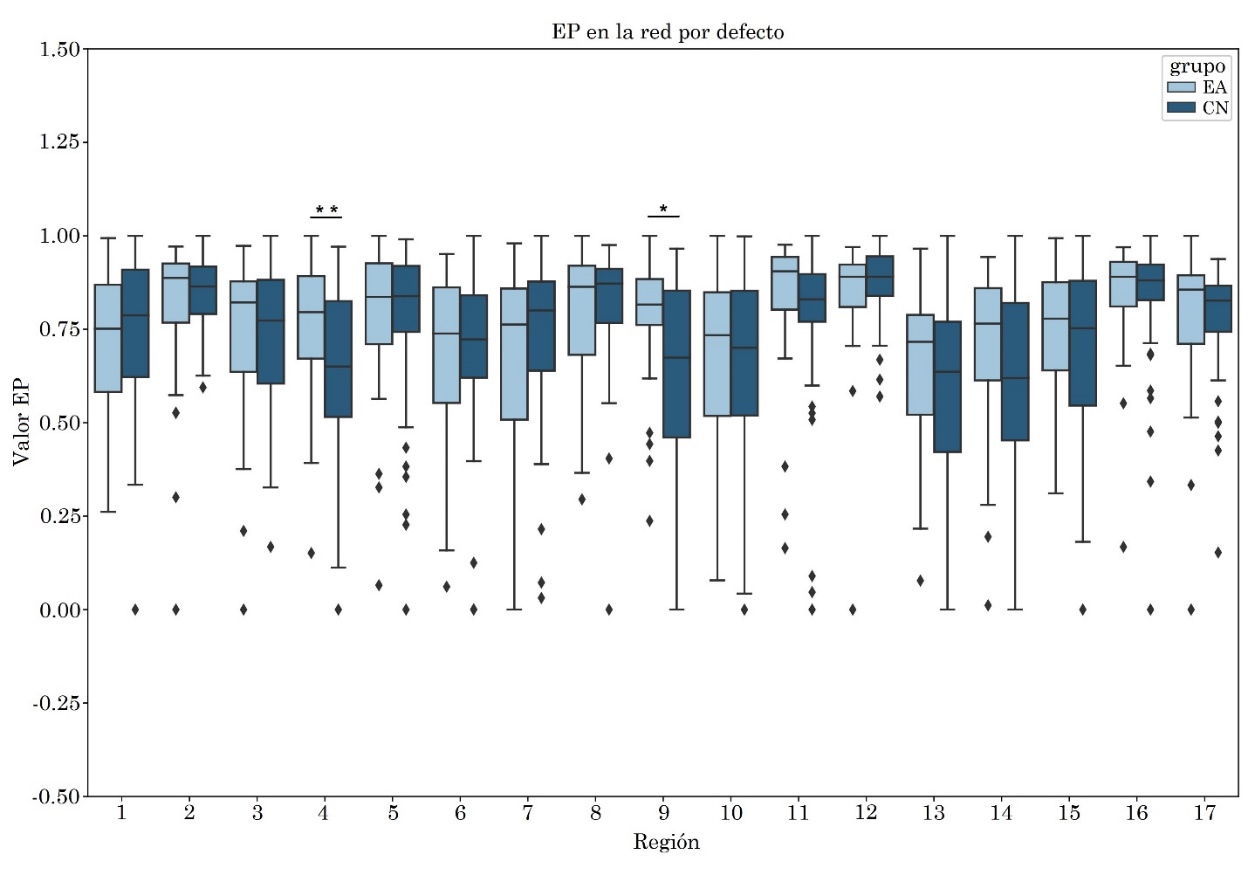
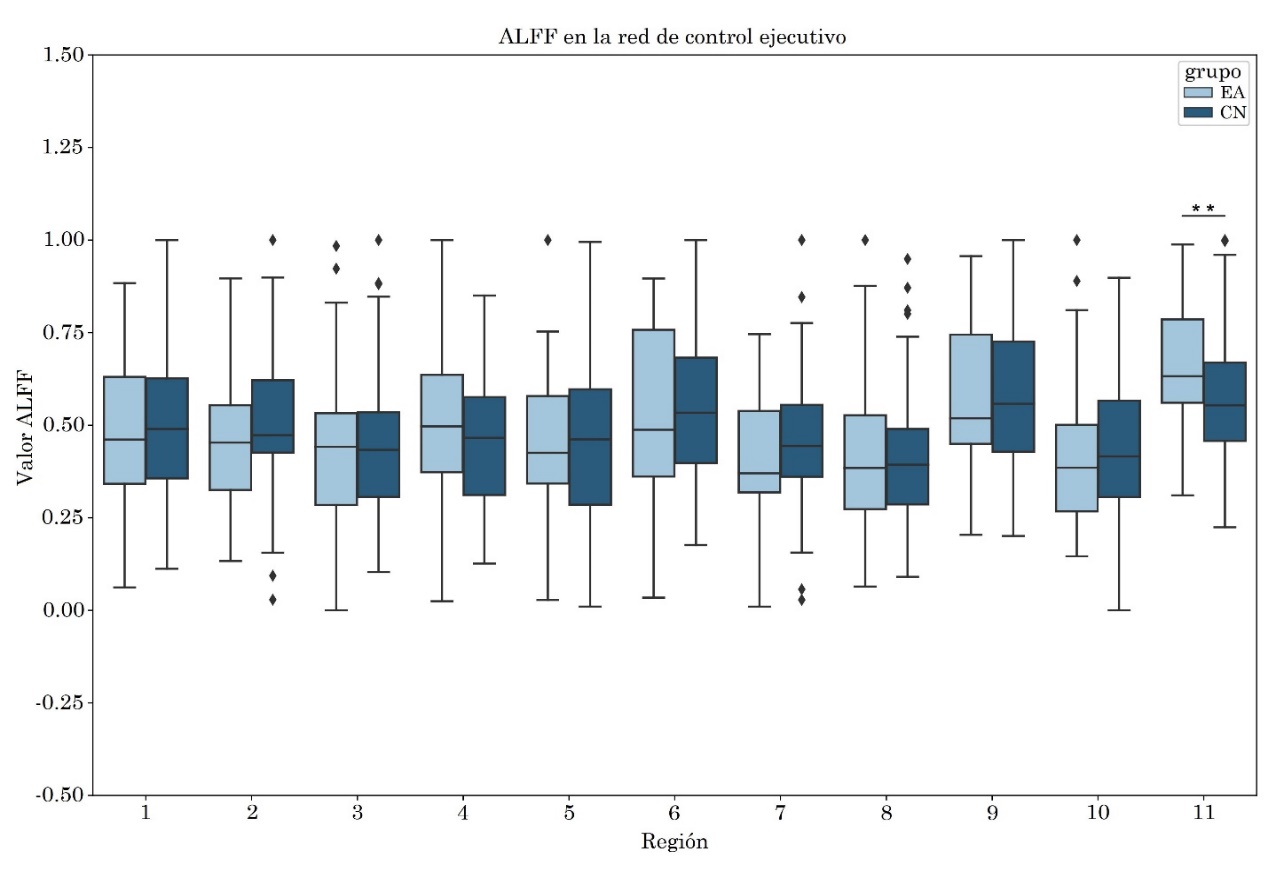
3.2 Red de control ejecutivo
Se observó aumento del ALFF en el núcleo caudado derecho en el grupo EA, con tamaño del efecto mediano de valor -0.43. Por otro lado, se obtuvo un incremento en la entropía del grupo EA en comparación con el grupo CN en las siguientes regiones: Crus I derecho con tamaño del efecto -0.38, giro frontal medio derecho con tamaño del efecto -0.35, núcleo caudado derecho con tamaño del efecto -0.37 y en la región que involucra al Crus I, Crus II y lóbulo VI derecho con tamaño del efecto -0.38. Las diferencias descritas previamente presentaron significancia estadística sin corrección FDR (Tabla 4, Figura 3 y Figura 4).
No se observaron diferencias entre grupos para la métrica fALFF. El diagrama de cajas puede visualizarse en la Figura S3 del apéndice.
de control ejecutivo. Fuente: elaboración propia
| ROI | ALFF | fALFF | PE | ||||||
| p1_unc | p2_unc | ES | p1_unc | p2_unc | ES | p1_unc | p2_unc | ES | |
| 1 | .47 | .53 | .01 | .88 | .12 | -.24 | .34 | .66 | .09 |
| 2 | .21 | .79 | .17 | .41 | .59 | .05 | .56 | .44 | -.04 |
| 3 | .41 | .59 | .06 | .20 | .80 | .18 | .24 | .76 | .16 |
| 4 | .85 | .15 | -.23 | .82 | .18 | -.20 | .78 | .22 | -.17 |
| 5 | .71 | .29 | -.12 | .58 | .42 | -.04 | .97 | .03 | -.38 |
| 6 | .41 | .59 | .05 | .83 | .17 | -.21 | .29 | .71 | .12 |
| 7 | .12 | .88 | .25 | .08 | .92 | .31 | .95 | .05 | -.35 |
| 8 | .52 | .48 | -.01 | .40 | .60 | .06 | .17 | .83 | .22 |
| 9 | .39 | .61 | .06 | .14 | .86 | .25 | .73 | .27 | -.13 |
| 10 | .41 | .59 | .05 | .79 | .21 | -.17 | .96 | .04 | -.38 |
| 11 | .98 | .02 | -.43 | .13 | .87 | .25 | .96 | .04 | -.37 |
p1_unc: valor-p no corregido para la cola CN > AD, p2_unc: valor-p no corregido
para la cola CN < AD, ES: tamaño del efecto, I: izquierdo, D: derecho.
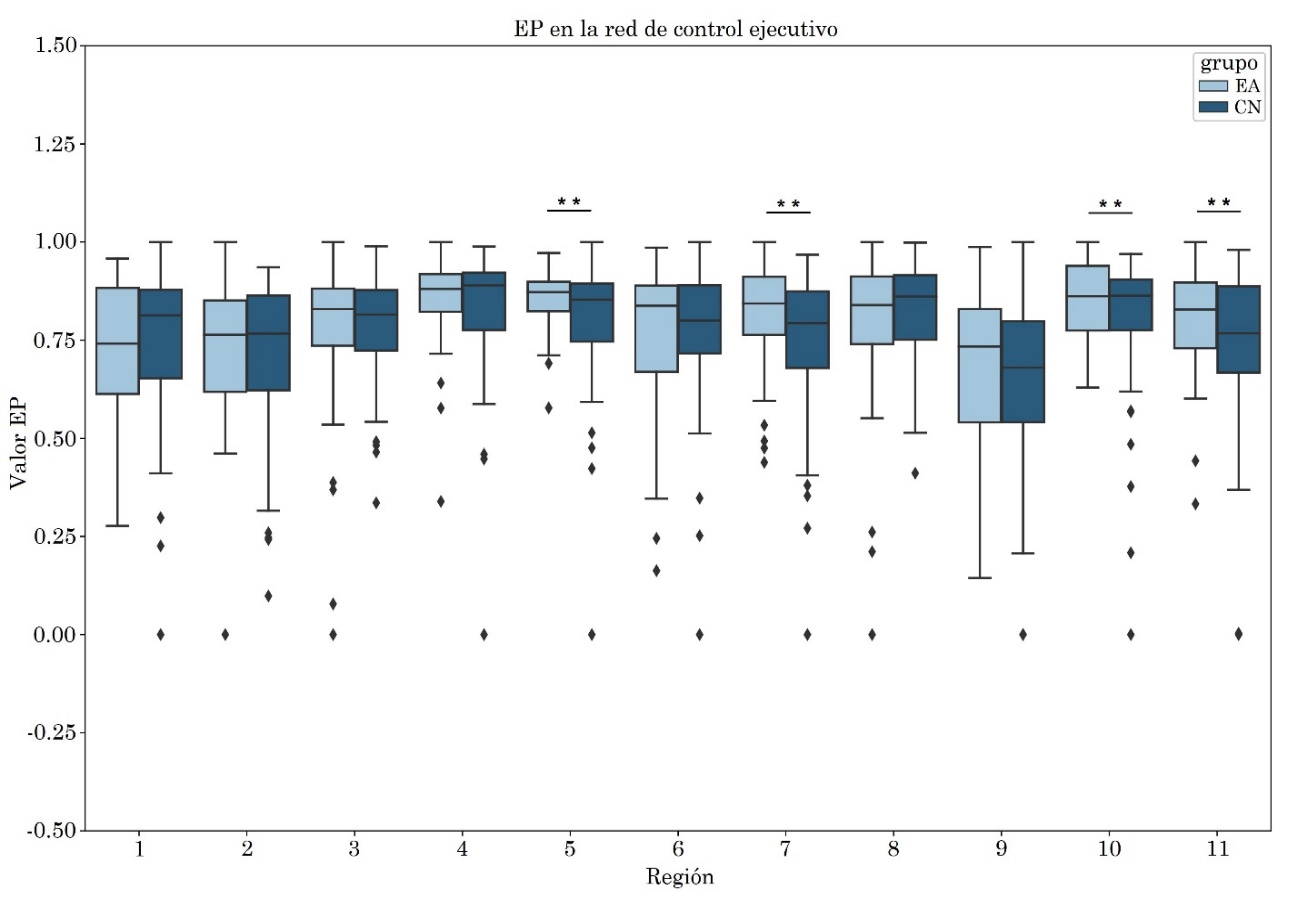
Los valores obtenidos al correlacionar las métricas con las escalas clínicas CDR-SB y MMSE para las regiones de la red de control ejecutivo se encuentran en las Tablas S1 y S2, respectivamente del apéndice.
4. DISCUSIÓN
En este estudio se investigó el potencial de la métrica entropía por permutaciones para extraer información sobre la complejidad cerebral en regiones que conforman la red por defecto y la red de control ejecutivo, se comparó su desempeño con las métricas espectrales ALFF y fALFF en pacientes con EA y sujetos sanos. Se encontró un aumento de la EP en pacientes con EA en ambas redes, adicionalmente se encontró un aumento en el ALFF en pacientes con EA en la red de control ejecutivo.
Al analizar la red por defecto en pacientes, se halló un incremento de la EP en la región que involucra a la corteza cingulada posterior y la precuña. Por otro lado, el estudio sobre la red de control ejecutivo reveló un incremento de la ALFF en el núcleo caudado y un incremento de la EP en las regiones del hemisferio derecho: giro frontal medio, núcleo caudado y la región que comprende al Crus I, Crus II y el lóbulo VI. En línea con estos resultados se ha reportado que la desorganización en la conectividad funcional de esta región es de importancia para el desarrollo de demencia en la EA [
Contrario a los resultados de esta investigación, estudios previos de rs-fMRI [
El estudio de [
La ALFF es una métrica que permite identificar la actividad neuronal espontánea de regiones específicas del cerebro a través de la intensidad de la señal BOLD. Esta ha sido utilizada como métrica característica para mejorar el desempeño de algoritmos de aprendizaje de máquina para la discriminación de sujetos con DCL y EA de individuos cognitivamente normales [
Dentro de las limitaciones de esta investigación, se encuentra el uso de grupos no pareados por sexo y edad. Es importante destacar que OASIS-3 es una base de datos que incluye sujetos con edades comprendidas entre los 42 años y los 95 años que fueron reclutados en el transcurso de 30 años. Algunos de los sujetos incluidos en este estudio fueron inicialmente etiquetados como cognitivamente normales que desarrollaron demencia por EA con el tiempo y otros ingresaron a la iniciativa OASIS-3 con diagnóstico de demencia tipo Alzheimer, para ambos casos la revisión realizada por los expertos clínicos permitió excluir sujetos con etiqueta EA que podían tener síntomas explicados por otras condiciones clínicas o no contar con un diagnóstico claro, a partir de la información proporcionada por la historia clínica disponible en la base de datos. Se debe tener en cuenta que en la base de datos no se especifica el estadio clínico de la demencia en la que se encuentran los sujetos, por lo que se tuvo que determinar a partir de mediciones de escalas que, si bien son fiables, no igualan el criterio clínico. Los enfoques de análisis reportados por estudios previos limitan la comparación de los hallazgos de este estudio, principalmente por la incertidumbre acerca del estadio de los sujetos clasificados como EA o deterioro cognitivo leve y tardío de la iniciativa ADNI, además del uso de métricas diferentes a la EP para cuantificar la complejidad de las señales BOLD. Además, se encontraron algunas limitaciones relacionadas con la presencia de artefactos en las imágenes y cambios en el diagnóstico durante el seguimiento longitudinal que disminuyó la muestra inicial. Aunque el tamaño de las señales es de mayor duración en comparación al estudio de PE realizado por [
Si bien las pruebas estadísticas dan una inferencia considerable de la relación entre dos o más variables, permitiendo una interpretabilidad dentro de los datos, su precisión predictiva no es su principal fortaleza, por lo que en investigaciones futuras se deberían considerar los efectos potenciales del aprendizaje de máquina para complementar los resultados presentados, donde se tendría la capacidad de generar un modelo a partir de la métrica no lineal PE y obtener predicciones reproducibles, con un análisis más robusto en la búsqueda de patrones discriminantes entre grupos, en este caso EA vs CN, que permitiría, además, obtener un mayor poder predictivo con la adición de mayor cantidad de muestras de las diferentes poblaciones y reducir la presencia de artefactos [
5. CONCLUSIONES
En el estudio actual se identificó incremento de la entropía en regiones de la red por defecto y la red de control ejecutivo en pacientes con EA. El hallazgo diferencial de mayor magnitud se manifestó en la corteza cingulada posterior y la precuña. La metodología implementada permitió demostrar la capacidad de la métrica entropía por permutaciones para capturar información sobre la función cerebral en la enfermedad de Alzheimer en comparación a las métricas espectrales. La métrica debe ser explorada en estudios longitudinales y en señales de mayor duración para evaluar su potencial para capturar patrones funcionales relacionados con la EA.
6. AGRADECIMIENTOS
Este trabajo fue apoyado por el Departamento Administrativo de Ciencias, Tecnología e Innovación (Colciencias), por el proyecto ‘Identificación de Biomarcadores Preclínicos en Enfermedad de Alzheimer a través de un Seguimiento Longitudinal de la Actividad Eléctrica Cerebral en Poblaciones con Riesgo Genético’, código 111577757635.
Los datos fueron proporcionados por OASIS-3: Principal Investigators: T. Benzinger, D. Marcus, J. Morris; NIH P50 AG00561, P30 NS09857781, P01 AG026276, P01 AG003991, R01 AG043434, UL1 TR000448, R01 EB009352.
Parte de la financiación de los autores fue aportada por el fortalecimiento de programas de ciencias médicas y de la salud con talento joven e impacto regional del Ministerio de Ciencia, Tecnología e Innovación (MinCiencias) – RC 752 – 2018. Estos recursos fueron administrados por la Corporación Académica para el Estudio de Patologías Tropicales de la Universidad de Antioquia
CONFLICTO DE INTERÉS
El proyecto no presenta ningún conflicto de interés.
CONTRIBUCIÓN DE LOS AUTORES
Aura C. Puche: diseño del experimento, procesamiento de datos, análisis de resultados y preparación inicial del manuscrito. Revisión, edición y aprobación del documento final.
John Fredy Ochoa Gómez: diseño del experimento y análisis de resultados; Revisión, edición y aprobación del documento final.
Yésika Alexandra Agudelo L.: análisis de resultados y preparación inicial del manuscrito. Revisión, edición y aprobación del documento final.
Jan Karlo Rodas Marín (experto clínico): selección de sujetos y análisis de resultados. Revisión, edición y aprobación del documento final.
Carlos Tobón Quintero (experto clínico): selección de sujetos y análisis de resultados. Revisión, edición y aprobación del documento final
7. REFERENCIAS
- arrow_upward [1] World Health Organization, “The Global Dementia Observatory Reference Guide World Health Organization,” Geneva, Switzerland. 2018. https://apps.who.int/iris/bitstream/handle/10665/272669/WHO-MSD-MER-18.1-eng.pdf
- arrow_upward [2] Y. Takeuchi; Y. Ariza-Araujo; S. Prada, “P3-349: Prevalence estimates of dementia in colombia (2005-2020): transitions and stage of disease,” Alzheimer’s Dement., vol. 10, no. 4S, pp. 758–758, Jul. 2014. https://doi.org/10.1016/j.jalz.2014.05.1442
- arrow_upward [3] S. I. Prada; Y. Takeuchi; Y. Ariza, “Costo monetario del tratamiento de la enfermedad deAlzheimer en Colombia”, Acta Neurol Colomb., vol. 30, no. 4, Oct. 2014. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-87482014000400004
- arrow_upward [4] M. A. Busche; B. T. Hyman, “Synergy between amyloid-β and tau in Alzheimer’s disease,” Nature Neuroscience, vol. 23, no. 10, pp. 1183–1193, Oct.2020. https://doi.org/10.1038/s41593-020-0687-6
- arrow_upward [5] L. Vermunt et al., “Duration of preclinical, prodromal, and dementia stages of Alzheimer’s disease in relation to age, sex, and APOE genotype,” Alzheimer’s Dement., vol. 15, no. 7, pp. 888–898, Jun. 2019. https://doi.org/10.1016/j.jalz.2019.04.001
- arrow_upward [6] B. C. Dickerson; F. Agosta; M. Filippi, “fMRI in Neurodegenerative Diseases: From Scientific Insights to Clinical Applications,” in fMRI techniques and protocols, Humana Press, New York, NY, 2016, pp. 699–739. https://doi.org/10.1007/978-1-4939-5611-1_23
- arrow_upward [7] F. Agosta; M. Pievani; C. Geroldi; M. Copetti; G. B. Frisoni; M. Filippi, “Resting state fMRI in Alzheimer’s disease: beyond the default mode network,” Neurobiol. Aging, vol. 33, no. 8, pp. 1564–1578, Aug. 2012. https://doi.org/10.1016/j.neurobiolaging.2011.06.007
- arrow_upward [8] A. P. Badhwar; A. Tam; C. Dansereau; P. Orban; F. Hoffstaedter; P. Bellec, “Resting-state network dysfunction in Alzheimer’s disease: A systematic review and meta-analysis,” Alzheimer’s Dement. Diagnosis, Assess. Dis. Monit., vol. 8, no. 1, pp. 73-85, Apr. 2017. https://doi.org/10.1016/j.dadm.2017.03.007
- arrow_upward [9] M. Weiler et al., “Default mode, executive function, and language functional connectivity networks are compromised in mild Alzheimer’s disease,” Curr. Alzheimer Res., vol. 11, no. 3, pp. 274–282, Mar. 2014. https://doi.org/10.2174/1567205011666140131114716
- arrow_upward [10] Q. Zhao; H. Lu; H. Metmer; W. X. Y. Li; J. Lu, “Evaluating functional connectivity of executive control network and frontoparietal network in Alzheimer’s disease,” Brain Res., vol. 1678, pp. 262–272, Jan. 2018. https://doi.org/10.1016/j.brainres.2017.10.025
- arrow_upward [11] E. L. Dennis; P. M. Thompson, “Functional Brain Connectivity Using fMRI in Aging and Alzheimer’s Disease,” Neuropsychol. Rev., vol. 24, no. 1, pp. 49–62, Mar. 2014. https://doi.org/10.1007/s11065-014-9249-6
- arrow_upward [12] H. Lv et al., “Resting-State Functional MRI: Everything That Nonexperts Have Always Wanted to Know,” Am. J. Neuroradiol., vol 39. no. 8, pp. 1390-1399, Aug. 2018. https://doi.org/10.3174/ajnr.A5527
- arrow_upward [13] L. Yang et al., “Gradual Disturbances of the Amplitude of Low-Frequency Fluctuations (ALFF) and Fractional ALFF in Alzheimer Spectrum,” Front. Neurosci., vol. 12, Dec. 2018. https://doi.org/10.3389/fnins.2018.00975
- arrow_upward [14] R. A. Poldrack, “The role of fMRI in Cognitive Neuroscience: where do we stand?,” Curr. Opin. Neurobio., vol. 18, no. 2, pp. 223–227, Apr. 2008. https://doi.org/10.1016/j.conb.2008.07.006
- arrow_upward [15] N. M. Timme; C. Lapish, “A Tutorial for Information Theory in Neuroscience,” eNeuro, vol. 5, no. 3, May 2018. https://doi.org/10.1523/ENEURO.0052-18.2018
- arrow_upward [16] S. Moguilner et al., “Dynamic brain fluctuations outperform connectivity measures and mirror pathophysiological profiles across dementia subtypes: A multicenter study,” Neuroimage, vol. 225, p. 117522, Jan. 2021. https://doi.org/10.1016/j.neuroimage.2020.117522
- arrow_upward [17] A. C. Yang; S.-J. Tsai; C.-P. Lin; C.-K. Peng, “A Strategy to Reduce Bias of Entropy Estimates in Resting-State fMRI Signals,” Front. Neurosci., vol. 12, p. 398, Jun. 2018. https://doi.org/10.3389/fnins.2018.00398
- arrow_upward [18] C. Bandt; B. Pompe, “Permutation Entropy: A Natural Complexity Measure for Time Series,” Phys. Rev. Lett., vol. 88, no. 17, Dec. 2001. http://stubber.math-inf.uni-greifswald.de/pub/full/prep/2001/11.pdf
- arrow_upward [19] B. Wang et al., “Decreased Complexity in Alzheimer’s Disease: Resting-State fMRI Evidence of Brain Entropy Mapping,” Front. Aging Neurosci., vol. 9, Nov. 2017. https://doi.org/10.3389/fnagi.2017.00378
- arrow_upward [20] J. Sun et al., “Complexity analysis of EEG, MEG, and fMRI in mild cognitive impairment and Alzheimer’s disease: A review,” Entropy, vol. 22, no. 2, Feb. 2020. https://doi.org/10.3390/e22020239
- arrow_upward [21] P. J. LaMontagne et al., “OASIS-3: Longitudinal Neuroimaging, Clinical, and Cognitive Dataset for Normal Aging and Alzheimer Disease,” medRxiv, pp. 2-37, Dec. 2019. https://doi.org/10.1101/2019.12.13.19014902
- arrow_upward [22] S. E. O’Bryant et al., “Staging dementia using clinical dementia rating scale sum of boxes scores: A Texas Alzheimer’s research consortium study,” Arch. Neurol., vol. 65, no. 8, pp. 1091–1095, Aug. 2008. https://doi.org/10.1001/archneur.65.8.1091
- arrow_upward [23] OASIS, “OASIS-3: Imaging Methods & Data Dictionary,” Apr. 2018. https://www.oasis-brains.org/files/OASIS-3_Imaging_Data_Dictionary_v1.8.pdf
- arrow_upward [24] S. Whitfield-Gabrieli; A. Nieto-Castanon, “Conn : A Functional Connectivity Toolbox for Correlated and Anticorrelated Brain Networks,” Brain Connect., vol. 2, no. 3, pp. 125–141, Jun. 2012. https://doi.org/10.1089/brain.2012.0073
- arrow_upward [25] W. R. Shirer; S. Ryali; E. Rykhlevskaia; V. Menon; M. D. Greicius, “Decoding Subject-Driven Cognitive States with Whole-Brain Connectivity Patterns,” Cereb. Cortex, vol. 22, no. 1, pp. 158–165, May. 2011. https://doi.org/10.1093/cercor/bhr099
- arrow_upward [26] C.-G. Yan; X.-D. Wang; X.-N. Zuo; Y.-F. Zang, “DPABI: Data Processing & Analysis for (Resting-State) Brain Imaging,” Neuroinform., vol. 14, no. 3, pp. 339–351, Jul. 2016. https://doi.org/10.1007/s12021-016-9299-4
- arrow_upward [27] X.-N. Zuo et al., “The oscillating brain: complex and reliable.,” Neuroimage, vol. 49, no. 2, pp. 1432–1445, Jan. 2010. https://doi.org/10.1016/j.neuroimage.2009.09.037
- arrow_upward [28] M. Riedl; A. Müller; N. Wessel, “Practical considerations of permutation entropy: A tutorial review,” Eur. Phys. J. Spec. Top., vol. 222, no. 2, pp. 249–262, Jun. 2013. https://doi.org/10.1140/epjst/e2013-01862-7
- arrow_upward [29] E. Glerean et al., “Reorganization of functionally connected brain subnetworks in high-functioning autism,” Hum. Brain Mapp., vol. 37, pp. 1066–1079, Dec. 2015. https://doi.org/10.1002/hbm.23084
- arrow_upward [30] H. Hentschke; M. C. Stüttgen, “Computation of measures of effect size for neuroscience data sets.,” Eur. J. Neurosci., vol. 34, no. 12, pp. 1887–1894, Dec. 2011. https://doi.org/10.1111/j.1460-9568.2011.07902.x
- arrow_upward [31] T. Yokoi et al., “Involvement of the precuneus/posterior cingulate cortex is significant for the development of Alzheimer’s disease: A PET (THK5351, PiB) and resting fMRI study,” Front. Aging Neurosci., vol. 10, Oct. 2018. https://doi.org/10.3389/fnagi.2018.00304
- arrow_upward [32] K. N. H. Dillen et al., “Aberrant functional connectivity differentiates retrosplenial cortex from posterior cingulate cortex in prodromal Alzheimer’s disease,” Neurobiol. Aging, vol. 44, pp. 114–126, Aug. 2016. https://doi.org/10.1016/j.neurobiolaging.2016.04.010
- arrow_upward [33] W. Koch et al., “Diagnostic power of default mode network resting state fMRI in the detection of Alzheimer’s disease,” Neurobiol. Aging, vol. 33, no. 3, pp. 466–478, Mar. 2012. https://doi.org/10.1016/j.neurobiolaging.2010.04.013
- arrow_upward [34] P. L. Lee et al., “Posterior Cingulate Cortex Network Predicts Alzheimer’s Disease Progression,” Front. Aging Neurosci., vol. 12, Dec. 2020. https://doi.org/10.3389/fnagi.2020.608667
- arrow_upward [35] L. Chenxi et al., “Abnormal Brain Network Connectivity in a Triple-Network Model of Alzheimer’s Disease,” J. Alzheimers. Dis., vol. 69, no. 1, pp. 237–252, 2019. https://doi.org/10.3233/JAD-181097
- arrow_upward [36] W. Jagust, “Imaging the evolution and pathophysiology of Alzheimer disease,” Nat. Rev. Neurosci., vol. 19, no. 11, pp. 687–700, Nov. 2018. https://doi.org/10.1038/s41583-018-0067-3
- arrow_upward [37] H. Zheng; K. Onoda; A. Nagai; S. Yamaguchi, “Reduced Dynamic Complexity of BOLD Signals Differentiates Mild Cognitive Impairment From Normal Aging,” Front. Aging Neurosci., vol. 12, Apr. 2020. https://doi.org/10.3389/fnagi.2020.00090
- arrow_upward [38] M. Grieder; D. J. J. Wang; T. Dierks; L.-O. Wahlund; K. Jann, “Default Mode Network Complexity and Cognitive Decline in Mild Alzheimer’s Disease,” Front. Neurosci., vol. 12, Oct. 2018. https://doi.org/10.3389/fnins.2018.00770
- arrow_upward [39] V. Boccardi; C. Comanducci; M. Baroni; P. Mecocci, “Of energy and entropy: The ineluctable impact of aging in old age dementia,” Int. J. Mol. Sci., vol. 18, no. 12, Dec. 2017. https://doi.org/10.3390/ijms18122672
- arrow_upward [40] Z. Wang, “Brain Entropy Mapping in Healthy Aging and Alzheimer’s Disease,” Front. Aging Neurosci., vol. 12, p. 372, Nov. 2020. https://doi.org/10.3389/fnagi.2020.596122
- arrow_upward [41] E. Tagliazucchi; P. Balenzuela; D. Fraiman; D. R. Chialvo, “Criticality in large-scale brain fMRI dynamics unveiled by a novel point process analysis,” Front. Physiol., vol. 3, Feb. 2012. https://doi.org/10.3389/fphys.2012.00015
- arrow_upward [42] A. Haimovici; E. Tagliazucchi; P. Balenzuela; D. R. Chialvo, “Brain Organization into Resting State Networks Emerges at Criticality on a Model of the Human Connectome.”, Phys. Rev. Lett., vol. 110, no.17, Apr. 2013. https://doi.org/10.1103/PhysRevLett.110.178101
- arrow_upward [43] D. Song; D. Chang, J. Zhang; Q. Ge; Y. F. Zang; Z. Wang, “Associations of brain entropy (BEN) to cerebral blood flow and fractional amplitude of low-frequency fluctuations in the resting brain,” Brain Imaging Behav., vol. 13, no. 5, pp. 1486–1495, Oct. 2019. https://doi.org/10.1007/s11682-018-9963-4
- arrow_upward [44] L. Mera-Jiménez; J. F. Ochoa-Gómez, “Redes neuronales convolucionales para la clasificación de componentes independientes de rs-fMRI,” TecnoLógicas, vol. 24, no. 50, pp. 97–115, Jan. 2021. https://doi.org/10.22430/22565337.1626
- arrow_upward [45] R. Liégeois et al., “Resting brain dynamics at different timescales capture distinct aspects of human behavior,” Nat. Commun., vol. 10, no. 1, May. 2019. https://doi.org/10.1038/s41467-019-10317-7
APÉNDICE
significativos. Fuente: elaboración propia.
de la red por defecto. Fuente: elaboración propia.
| ROI | ALFF | Falff | PE | ||||||
| r | P | r | P | r | p | ||||
| 1 | .01 | .94 | -.13 | .45 | -.14 | .41 | |||
| 2 | -.10 | .55 | -.27 | .11 | -.04 | .83 | |||
| 3 | .07 | .66 | -.12 | .48 | .04 | .82 | |||
| 4 | .06 | .74 | .05 | .79 | .16 | .34 | |||
| 5 | .10 | .58 | .13 | .46 | -.17 | .31 | |||
| 6 | .05 | .76 | -.05 | .79 | .02 | .92 | |||
| 7 | .05 | .77 | .02 | .90 | -.13 | .45 | |||
| 8 | .06 | .72 | -.01 | .96 | .24 | .17 | |||
| 9 | .07 | .70 | -.01 | .95 | .06 | .75 | |||
| 10 | .13 | .44 | -.01 | .94 | .01 | .97 | |||
| 11 | .09 | .59 | .25 | .15 | -.16 | .34 | |||
| 12 | -.06 | .73 | .01 | .94 | .12 | .49 | |||
| 13 | .11 | .54 | .08 | .66 | .03 | .86 | |||
| 14 | .10 | .55 | .03 | .84 | .15 | .38 | |||
| 15 | .04 | .80 | .06 | .71 | -.06 | .73 | |||
| 16 | .05 | .77 | -.03 | .87 | -.20 | .24 | |||
| 17 | .05 | .76 | .27 | .12 | .21 | .21 | |||
de la red por defecto. Fuente: elaboración propia.
| ROI | ALFF | fALFF | PE | ||||||
| r | P | r | P | r | p | ||||
| 1 | .11 | .53 | .12 | .48 | .07 | .68 | |||
| 2 | .07 | .68 | .03 | .88 | .12 | .47 | |||
| 3 | .17 | .32 | -.06 | .74 | .07 | .67 | |||
| 4 | .15 | .38 | -.05 | .78 | -.03 | .87 | |||
| 5 | .03 | .85 | -.07 | .68 | .11 | .54 | |||
| 6 | .13 | .44 | -.02 | .90 | .11 | .54 | |||
| 7 | -.14 | .43 | .08 | .66 | .13 | .46 | |||
| 8 | -.08 | .65 | -.12 | .50 | -.31 | .07 | |||
| 9 | .11 | .54 | -.06 | .74 | .07 | .68 | |||
| 10 | .09 | .61 | .11 | .51 | .32 | .06 | |||
| 11 | -.13 | .46 | .05 | .75 | .14 | .41 | |||
| 12 | .05 | .79 | .07 | .68 | .07 | .66 | |||
| 13 | .04 | .82 | .05 | .78 | .09 | .62 | |||
| 14 | .13 | .44 | .02 | .93 | .02 | .92 | |||
| 15 | .12 | .47 | -.05 | .75 | .07 | .67 | |||
| 16 | -.08 | .65 | .05 | .79 | .47 | .00 | |||
| 17 | .02 | .93 | .00 | .98 | -.13 | .44 | |||
de la red de control ejecutivo. Fuente :elaboración propia.
| ROI | ALFF | fALFF | PE | ||||||
| r | P | R | p | r | p | ||||
| 1 | .16 | .35 | -.16 | .35 | -.18 | .30 | |||
| 2 | .08 | .62 | -.02 | .89 | -.28 | .10 | |||
| 3 | .01 | .98 | -.05 | .79 | .13 | .45 | |||
| 4 | .02 | .92 | -.01 | .95 | -.13 | .46 | |||
| 5 | .16 | .35 | .07 | .68 | .07 | .71 | |||
| 6 | .07 | .69 | -.15 | .38 | -.09 | .60 | |||
| 7 | -.02 | .91 | .03 | .85 | .03 | .84 | |||
| 8 | .03 | .86 | .13 | .44 | .02 | .90 | |||
| 9 | .01 | .93 | .10 | .55 | -.03 | .85 | |||
| 10 | .21 | .22 | -.06 | .73 | .31 | .06 | |||
| 11 | .04 | .83 | .34 | .04 | .16 | .36 | |||
de la red de control ejecutivo. Fuente: Fuente: elaboración propia.
| ROI | ALFF | fALFF | PE | ||||||
| r | p | R | p | r | p | ||||
| 1 | .14 | .43 | .07 | .67 | .19 | .27 | |||
| 2 | .04 | .82 | .21 | .22 | .15 | .37 | |||
| 3 | .04 | .83 | -.04 | .83 | .17 | .33 | |||
| 4 | -.18 | .28 | -.05 | .76 | -.04 | .80 | |||
| 5 | -.10 | .54 | .02 | .93 | -.16 | .36 | |||
| 6 | .11 | .52 | -.05 | .76 | .07 | .67 | |||
| 7 | .09 | .62 | -.12 | .49 | .27 | .10 | |||
| 8 | .02 | .91 | -.20 | .24 | .02 | .92 | |||
| 9 | .14 | .42 | -.08 | .65 | .01 | .97 | |||
| 10 | -.05 | .78 | .11 | .51 | .11 | .53 | |||
| 11 | .03 | .84 | -.25 | .14 | .04 | .80 | |||