Prostasomas: búsqueda de biomarcadores para la detección temprana del cáncer prostático
Prostasomas: search of biomarkers for the early detection of prostate cancer
02 de junio de 2018
Aceptado: 22 de octubre de 2018
Resumen
El cáncer de próstata es la segunda enfermedad más diagnosticada en hombres a nivel mundial, con una tasa de mortalidad creciente en los últimos años. Actualmente, se cuenta con dos pruebas de detección temprana: la medición de los niveles en sangre del antígeno prostático específico y el tacto rectal de la próstata. Sin embargo, estas pruebas no presentan óptima especificidad y sensibilidad para su detección. Aunque diferentes estudios han buscado nuevos biomarcadores mediante la implementación de tecnologías, como secuenciación de nueva generación, espectrometría de masas, entre otras, aún persisten las mismas desventajas, por lo que no les ha permitido a estos su uso en la práctica clínica; razón por la cual, el descubrimiento de nuevos biomarcadores para el diagnóstico de cáncer de próstata, constituye un desafío para la comunidad científica.
Los prostasomas corresponden a vesículas extracelulares secretadas por el tejido prostático normal o tumoral que pueden ser detectadas en diferentes fluidos. Estructuralmente, los prostasomas difieren de otros exosomas, por su tamaño, composición de membrana y contenido específico de proteínas, lo que los convierten en una fuente potencial y novedosa de biomarcadores clínicos.
En este contexto, esta revisión presenta un panorama general de los biomarcadores proteicos, aislados desde prostasomas presentes en diferentes fluidos biológicos, para el posible diagnóstico de cáncer de próstata. Para ello se realizó una búsqueda sistemática en PubMed para estudios en proteómica para cáncer de próstata, con criterios como: vesículas extracelulares, exosomas y prostasomas, asimismo, sangre, orina, líquido seminal, entre otras muestras biológicas.
Palabras clave: Biomarcadores; cáncer de próstata; vesículas extracelulares; prostasomas; proteínas.
Abstract
Prostate cancer is the second most diagnosed disease among men worldwide, with a growing mortality rate in recent years. Currently, two methods can be used for early detection: prostate-specific antigen blood tests and digital rectal exams. However, their specificity and detection sensitivity are not optimal. Although several studies have searched for new biomarkers by implementing technologies such as next-generation sequencing and mass spectrometry, the same disadvantages persist. For that reason, biomarkers are not allowed in clinical practice and, therefore, discovering new ones to diagnose prostate cancer is a challenge for the scientific community.
Prostasomes are extracellular vesicles secreted by healthy or tumoral prostatic tissue that can be detected in different fluids. Prostasomes are different from other exosomes in size, membrane composition, and specific protein content, which makes them a potential and novel source of clinical biomarkers.
In such context, this review article presents a general overview of protein biomarkers isolated from prostasomes present in different biological fluids for the possible diagnosis of prostate cancer. For that purpose, a systematic search was conducted in PubMed to find proteomic studies regarding prostate cancer using terms such as extracellular vesicles, exosomes, prostasomes, blood, urine, and seminal fluid, among other biological samples.
Keywords: Biomarkers, Prostate Cancer, Extracellular Vesicles, Prostasomes, Proteins.
1. INTRODUCCIÓN
El cáncer de próstata (CaP) es la se-gunda neoplasia más común en hombres [
El diagnóstico de CaP cuenta con dos pruebas de detección temprana, la medi-ción del Antígeno Prostático Específico (PSA) y el tacto rectal de la próstata [
En cuanto al tacto rectal, se tiene que esta prueba genera incomodidad, ya que implica la exploración digital de la glán-dula a través del recto, además, solo per-mite palpar la cara anterior de la prósta-ta, por lo que resulta bastante ineficiente, se estima que del 23 al 45 % de los CaP se pasan por alto y aproximadamente el 50 % se diagnostican en una etapa avanzada [
El test PROGENSA-PCA3 se basa en la amplificación del ARNm de PCA3 en la orina medida por transcripción. El resul-tado se traduce en un puntaje que es va-lorado en el contexto clínico de cada pa-ciente. Esta prueba urinaria de PCA3 usada en conjunto con la prueba sérica de PSA incrementa el umbral de detección del CaP [
Los pacientes sospechosos para CaP por lo general deben someterse a biopsias de próstata en serie para la vigilancia activa. Sin embargo, el análisis histopato-lógico puede subestimar el grado o exten-sión de la enfermedad o incluso no permi-tir la observación del tejido tumoral, esto debido a la naturaleza multifocal y hete-rogeneidad de los tumores prostáticos [
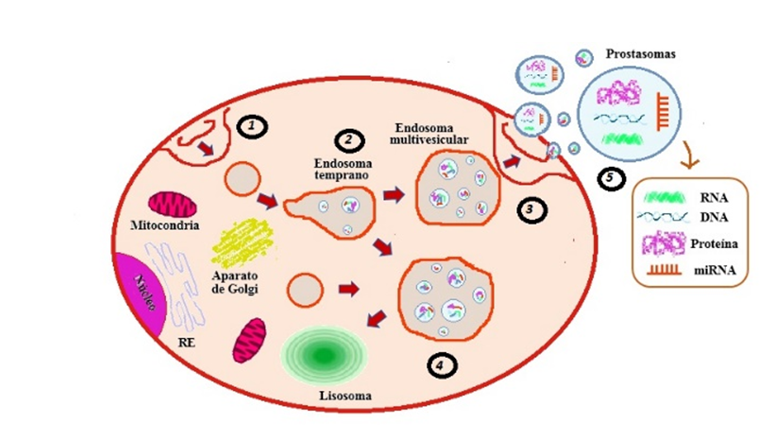
Mediante estudios In vitro se demos-tró que todos los tipos de células huma-nas liberan vesículas extracelulares (VEs) y que por lo tanto es común observarlas en los diferentes fluidos corporales [
Los fluidos prostáticos contienen VEs de dos tipos, prostasomas y exosomas: los prostasomas (150-500 nm), son producidos por células epiteliales ductales prostáti-cas que son un componente normal del líquido seminal y juegan un papel en la fertilidad masculina; y exosomas, que son nanovesículas especializadas (30-100 nm) con una morfología en forma de copa, secretada activamente por una variedad de células normales y tumorales [
Partiendo de que las VEs de las célu-las cancerosas tienen contenidos únicos y específicos del cáncer, junto con la obser-vación de que los prostasomas están pre-sentes tanto en la sangre como en la orina de los pacientes con CaP, surgió la hipó-tesis de que las VEs pueden proporcionar marcadores útiles para el CaP. Dicha idea fue respaldada por los primeros estudios en los que se compararon los perfiles de proteoma de VEs aisladas de cultivos de líneas celulares tumorales y no tumorales de próstata, en los cuales se identificaron múltiples proteínas que podrían consti-tuir posibles biomarcadores proteicos candidatos para CaP [
2. METODOLOGÍA
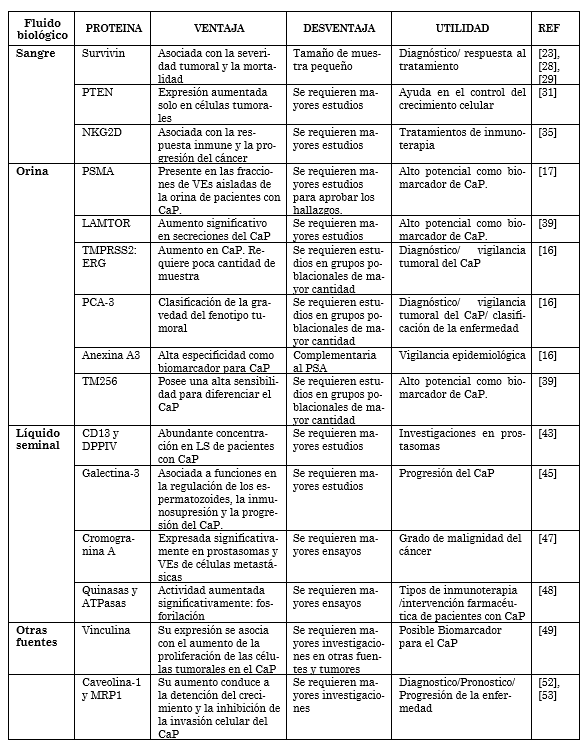
Se realizó una búsqueda sistemática en PubMed para estudios en proteómica para cáncer de próstata, con criterios como: VEs, exosomas y prostasomas, asi-mismo, sangre, orina, líquido seminal, entre otras muestras biológicas. Después de una revisión manual 39 artículos ori-ginales fueron incluidos así, 16 para flui-do sanguíneo, 7 para orina, 9 para líquido seminal y 7 para otras fuentes biológicas. la bibliografía fue recopilada entre marzo y julio de 2018.
3. PROSTASOMAS Y CAP
Los prostasomas fueron inicialmente caracterizados por Gunnar Ronquist a finales de 1970 [
Diferentes estudios mostraron que es-tos prostasomas poseen diversas funcio-nes fisiológicas, generalmente relaciona-das con las funciones de la célula paren-tal, tienen la capacidad de llevar molécu-las como lípidos o proteínas a los esper-matozoides durante su viaje al ovocito, y poseen funciones tales como: actuar como mensajeros intercelulares entre las célu-las secretoras de la próstata y las células espermáticas, ser una especie de «reser-vorio» que los espermatozoides pueden usar dependiendo de las condiciones del entorno [
El contenido proteico de los prosta-somas es amplio; en un estudio realizado por Utleg et al, [
Las células tumorales y metastásicas de CaP pobremente diferenciadas tienen la capacidad de sintetizar y exportar ma-yor concentración de prostasomas, ya que la arquitectura de tejido se altera durante el proceso de carcinogénesis favoreciendo la liberación de prostasomas al espacio intersticial. Además, se conoce que las células tumorales tienden a explotar los sistemas fisiológicos del huésped con el fin de obtener apoyo en términos de, nu-trición, crecimiento y metástasis. Parece que varias habilidades prostasomales, que se desarrollan para ayudar a las células espermáticas en la fertilización, también pueden ser promotoras en la transición de una célula normal a una neoplásica y ayudar a las células cancerígenas, mal diferenciadas, a sobrevivir y hacer metás-tasis [
4. PROSTASOMAS EN FLUIDO SANGUÍNEO
El concepto general de que los exoso-mas aislados de la sangre puedan servir como posibles biomarcadores para la de-tección del cáncer fue recientemente ratificado para el cáncer de páncreas, ya que en este modelo se identificó que los exosomas de las células tumorales tienen contenidos específicos y únicos para el cáncer [
Como se mencionó anteriormente, las VEs secretadas por la membrana se desa-rrollan inicialmente dentro de los endo-somas multivesiculares intracelulares, durante este proceso, proteínas y ácidos nucleicos son encapsulados en los exoso-mas. Una vez se da la liberación en el espacio extracelular, dichas VEs entran en la circulación [
Varios biomarcadores moleculares de-rivados de la sangre para la detección del CaP han estado disponibles a lo largo de los años [
Sin embargo, se debe considerar que en el fluido sanguíneo no solo se encuen-tran prostasomas, si no también otras VEs que son secretadas activamente por la mayoría, sino todas, las células nuclea-das, generando así una contaminación y por consecuencia convierte el proceso de aislamiento de los prostasomas en un procedimiento complicado [
El plasma sanguíneo fue recolectado de dos grupos de pacientes con CaP y sujetos controles, pareados por edad: el primer grupo incluyó muestras de 20 pacientes con un PSA de 94-2706 ng/ml y 20 controles con niveles de PSA inferiores a 2.5 ng/ml. El segundo grupo estaba constituido por 59 pacientes con CaP y un PSA de 1.1 a 39.1 ng/ml y se compararon con 20 controles con un PSA entre 1.7–14.8 ng/ml con resultados benignos de biopsia transrectal. Se detectaron niveles de prostasomas relevantes en las mues-tras de sangre de los pacientes con CaP, hasta 7 veces más altos en comparación con las 20 muestras de los sujetos contro-les [23].
Al usar este ensayo, se demuestra con éxito que los prostasomas se pueden de-tectar en niveles elevados en el plasma sanguíneo de pacientes con CaP, además los resultados también muestran que este análisis puede distinguir pacientes con puntajes de Gleason medio y alto de aque-llos puntajes bajos, lo que permite corre-lacionar la agresividad del tumor. En conclusión, debido a su alta sensibilidad y especificidad para prostasomas en mues-tras de sangre, el ensayo realizado en este estudio es prometedor como un pro-cedimiento para el aislamiento de estas vesículas, sin embargo, se deben conti-nuar con los experimentos [
Por otro lado, la proteína antiapoptó-tica Survivin pertenece a una familia conocida de oncoproteínas, aislada de vesículas exosómicas derivadas de la sangre, expresada en la mayoría de tumo-res malignos [
Como el contenido del exosoma refleja su fuente celular, estos pueden contener proteínas oncogénicas o proteínas supre-soras de tumores, por lo tanto, puede conducir a efectos positivos o negativos en relación con la progresión del cáncer. En esta investigación, realizada por Ga-briel et al., en el 2013, se recolectan 30 muestras de pacientes con CaP en un estadio avanzado (T3 / T4) y antes de la prostatectomía, además de 8 hombres voluntarios sanos de 50 y 65 años de edad [
Los microRNA extracelulares incrus-tados en exosomas circulantes pueden servir como biomarcadores pronósticos en el cáncer. En una investigación realizada por Huang et al en el año 2015, realizaron una secuenciación de RNA para identifi-car miRNA exosomal en 50 candidatos sanos y 36 pacientes con CaP, de los cua-les 23 pacientes eran resistentes a la castración (CRPC). Los miRNA se evalua-ron mediante la técnica de PCR en tiem-po real. El estudio identificó dos candida-tos de miRNA (miR-1290 y miR-375), sin embargo, los miR -375 asociados con el cáncer han sido implicados en una varie-dad de carcinomas, incluidos el CaP, la regulación de este se ha correlacionado con la metástasis del CaP, pero también con la supervivencia de pacientes con cáncer esofágico; por otro lado, los miR-1290 tuvieron una mejor predicción en los resultados en comparación con miR-375, sin embargo, sus expresión aumentada en suero discrimina para el cáncer de pán-creas en estadio bajo y también está invo-lucrado en el cáncer de mama, en conse-cuencia su papel directo para el CaP permanece indeterminado. No obstante, en esta investigación observaron ciertas diferencias significativas en los resulta-dos que sugieren los miRNA exosomales circundantes como posibles biomarcado-res sensibles para el pronóstico de pa-cientes con CRPC [<cr n="33">33</cr
En otro estudio realizado por Bryant et al [
Las células cancerígenas producen grandes cantidades de VEs, por lo que se ha propuesto que los exosomas tumorales influyen en la respuesta inmune y posi-blemente contribuyen a la progresión del cáncer [
5. PROSTASOMAS EN ORINA
La orina es un fluido de desecho cor-poral que se puede obtener fácilmente, por lo que es ideal para la determinación y el análisis de biomarcadores. Esta es una mezcla compleja de proteínas, sales, urea y metabolitos filtrados y secretados que pueden variar, no solo en situaciones fisiológicas, sino especialmente en enfer-medades que afecten el sistema genitou-rinario [
En la actualidad, se sabe que hay pre-sencia de prostasomas en fracciones de VEs aisladas de la orina mediante la de-tección de proteínas específicas de la próstata, entre las que se destacan el antígeno prostático específico de mem-brana (PSMA), la fosfatasa acida prostáti-ca y la trasglutaminasa prostática [
La orina contiene células tumorales prostáticas intactas y cuerpos apoptóticos derivados de dichas células. Las células y la mayoría de los cuerpos apoptóticos son considerablemente más grandes que los prostasomas, por lo tanto, pueden sepa-rarse fácilmente de estos mediante cen-trifugación diferencial [
A pesar de que distintos tejidos dentro del sistema genitourinario masculino, como el renal, testicular, entre otros [
En un estudio [
Otro estudio [
Actualmente, se han identificado aproximadamente 1000 miRNAs en hu-manos y cada uno de ellos puede estar relacionado o apuntar a genes que influ-yen en vías de señalización importantes para la progresión de varios tipos de cán-cer. Se ha comprobado que varios miRNA tienen su función alterada o se encuen-tran diferencialmente presentes en el CaP y parecen influir en la actividad an-tiapoptótica [
En un estudio poblacional [
6. LÍQUIDO SEMINAL
El Fluido Seminal (FS) está compuesto por altas concentraciones de proteínas, iones solubles y moléculas pequeñas, aproximadamente el 40 % del FS es mate-rial prostático, liberado después de la eyaculación [
El FS tiene una serie de ventajas so-bre la sangre y la orina en términos de su potencial como fuente de biomarcadores específicos de CaP. En primer lugar, los constituyentes prostáticos están altamen-te enriquecidos en el FS en comparación con otros fluidos corporales. De hecho, el PSA se describió originalmente en FS, donde existe una concentración de apro-ximadamente 5-6 órdenes de magnitud mayor que en el suero sanguíneo. En se-gundo lugar, a diferencia de las células epiteliales prostáticas malignas y sus productos que solo ingresan a la circula-ción tras la trasgresión de las barreras del tejido sanguíneo, las células y sus secreciones se liberan de forma natural en el FS, tanto en las glándulas normales como en las malignas. Ambos factores sugieren que los biomarcadores se detec-tarían en FS antes que, en sangre, lo que destaca el potencial de este líquido para la detección temprana, incluidos los cam-bios premalignos. En tercer lugar, el FS no solo contiene material libre de células de la próstata, sino también células tumo-rales detectables antes del diagnóstico de CaP basado en la biopsia, con la tasa de proliferación de estas células potencial-mente valiosa en el control de pacientes con enfermedad de bajo grado en regíme-nes de vigilancia. [
Debido a que el FS es un medio mole-cular diverso y abundante, compuesto por ácidos nucleicos, proteínas, lípidos, azú-cares, pequeños metabolitos e iones [
Como se ha mencionado, los prosta-somas cumplen una función en la regula-ción de los espermatozoides, la inmuno-supresión y la progresión del CaP. Galectin-3 es una proteína de unión a carbohidratos multifuncional que se caracterizó inicialmente como un sustrato proteolítico para el PSA y se demostró que se asociaba con prostasomas en el semen humano [
En otro estudio publicado por MJ et al, donde estudiaron la precisión pronós-tica o diagnóstica para el CaP por medio del FS, se analizan una cohorte de mues-tras de 152 hombres sospechosos de tener CaP por los resultados iniciales de un PSA aumentado y/o un tacto rectal anor-mal; los pacientes se clasificaron en dos grupos: alto riesgo y bajo riesgo [
En una nueva investigación realizada por Dubois et al, primeramente, se reco-lecta plasma seminal de 48 varones con CaP para evaluar la expresión de proteí-nas de chromogranin (cg) en prostasomas y VEs de células malignas de la próstata. Por medio de la técnica de ELISA se ob-servaron patrones divergentes de pépti-dos de chromogranin al comparar prosta-somas y VEs, lo que indican un cambio fenotípico [
Las propiedades del CaP cambian drásticamente cuando las células se vuel-ven independientes de andrógenos y se produce la metástasis. Se ha revelado que estas células metastásicas del CaP pue-den producir prostasomas y exportarlas al espacio extracelular; por lo tanto, se cree que los prostasomas producidos por las propias células de CaP son los princi-pales actores en el proceso maligno y que la resistencia contra el sistema inmune es una característica central en el proceso de selección [
7. OTRAS FUENTES ASOCIADAS A PROSTASOMAS
Existen otras fuentes como posibles biomarcadores asociadas a prostasomas, se conoce que las vesículas extracelulares además de estar circulando en diferentes fluidos corporales, poseen diferentes moléculas, entre ellas RNA [
Debido a que las VE son valiosas he-rramientas para la detección, el pronósti-co y tratamiento del cáncer, se realizó el análisis de microvesículas liberadas al entorno extracelular utilizando líneas celulares del CaP metastásico PC-3, por medio de dos técnicas, la cromatografía líquida nanocapilar y espectrometría de masas; lograron identificar 266 proteínas con secuencias peptídicas, debido a que varias de estas proteínas se han identifi-cado anteriormente en exosomas, esto indica que las vesículas PC-3 tienen ca-racterísticas en común [
En particular, se mostraron tres pro-teínas de interés, CDCP1, la tetraspanin CD151 y CD147, además de otras proteí-nas como la TCTP y la neuropilina, todas estas asociadas y / o desreguladas en el CaP; por otro lado, fue muy relevante encontrar niveles abundantes de vinculi-na (proteína de la familia actina involu-crada en la interacción entre el citoesque-leto y la matriz extracelular) en las mi-crovesículas de PC-3. Esta última parece ser un biomarcador prometedor ya que su expresión se asocia con el aumento de la proliferación de las células tumorales en el CaP [
La Vigilancia Activa (VA) del CaP en estadio temprano se ha venido implemen-tando en la última década, ya que el diag-nóstico temprano y el tratamiento curati-vo contribuyen con la supervivencia de hombres con cánceres de riesgo desfavo-rable, sin embargo, existen preocupacio-nes significativas con respecto al sobre-diagnóstico y el sobretratamiento de hombres con CaP de riesgo menor. Aun-que las cohortes de VA publicadas difie-ren según el protocolo utilizado, las tasas de metástasis de la enfermedad y la mor-talidad específica por CaP son extrema-damente bajas en el mediano plazo (5-10años). Tales resultados parecen estar estrechamente relacionados con los crite-rios específicos del programa para la selección, monitoreo e intervención, sugi-riendo que la VA al igual que otras estra-tegias de manejo podrían ser más eficien-tes para la correcta estratificación de pacientes con CaP. Con el fin de refinar la estratificación del riesgo, el monitoreo individual a través de biomarcadores específicos podrían ser una opción, si estos marcadores son de tipo circulantes, se evade la desventaja asociada al sub-muestreo inherente a la biopsia prostáti-ca [
Ya que algunos estudios han sugerido los prostasomas como posibles indicado-res de la progresión del cáncer, se encon-tró que Caveolina (Cav-1) es una proteína de membrana que se unen fuertemente al colesterol, su expresión aumentada está acompañada por la adquisición de fenoti-po de resistencia a múltiples fármacos (MDR) en las células cancerígenas de la próstata [
En otro estudio realizado en tres lí-neas celulares de próstata (normal, an-drógeno-sensible y andrógeno-independiente) derivadas de metástasis a ganglios linfáticos y hueso, respectiva-mente, con el fin de comprender su posi-ble papel en la quimiorresistencia al CaP, se muestra que la proteína de resistencia Multirresistente 1 (MRP1) se encuentra en fracciones de balsa lipídica de células tumorales y que el número de caveolas aumenta con la adquisición de maligni-dad. MRP1 no solo se encontró en la membrana plasmática asociada con las balsas lipídicas sino también en las acu-mulaciones citoplásmicas que se localizan con los marcadores de prostasoma Ca-veolin-1 y CD59 [
Debido a la transferencia de material envuelto en microvesículas desde la célu-las tumorales a las células normales, se realizó un estudio con el objetivo de iden-tificar la expresión de los genes específi-cos de la próstata en células normales de médula cultivadas con células de CaP [
8. CONCLUSIONES
La poca especificidad y sensibilidad del PSA como marcador diagnóstico para el CaP ha llevado a la comunidad científi-ca a una intensa búsqueda de nuevos bio-marcadores en fuentes biológicas como la orina, la sangre, fluidos prostáticos y otros. La composición molecular de las vesículas extracelulares propias de la próstata ha revelado proteínas como po-sibles candidatas a biomarcadores para el diagnóstico, estratificación y pronóstico del CaP. El desarrollo de estos marcado-res requiere el análisis en grandes cohor-tes de pacientes, además, de aumentar la pureza de los aislamientos de los prosta-somas contribuyentes en sangre, orina o fluidos prostáticos.
Una ventaja de los prostasomas mues-treados a partir de sangre u orina es que representan el estado general del orga-nismo y el desarrollo del CaP, además de ser mínimamente invasivos.
La composición molecular de los pros-tasomas como proteínas y moléculas de ARN, entre otras, y la capacidad de estos de ser estables y que el ARN dentro de su lumen pueda resistir la ARNasa exógena, proporciona la capacidad para influir en el desarrollo y la metástasis del CaP. Por lo tanto, los prostasomas pueden conside-rarse abundantes en posibles marcadores para el diagnóstico/pronóstico del cáncer de próstata y servir como lectura para el estado de sus células de origen.
Sin embargo, las moléculas asociadas con prostasomas ya identificadas deben probarse en estudios de cohortes mayores de pacientes, para determinar su especi-ficidad y sensibilidad en el diagnóstico de CaP; de igual manera, se debe ampliar el campo de investigación en metodologías más eficientes para el aislamiento de los prostasomas en los distintos fluidos bio-lógicos, para su posterior estudio en es-tos, ya que esta es una de las principales debilidades que los prostasomas tienen.
9. AGRADECIMIENTOS
Agradecemos la financiación otorgada por el Instituto Tecnológico Metropoli-tano, a través del proyecto de investiga-ción P10240.
10. REFERENCIAS
- arrow_upward [1] B. Pullar and N. Shah, "Prostate cancer," Surg., vol. 34, no. 10, pp. 505–511, Oct. 2016.
- arrow_upward [2] J. Ferlay et al., "GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012 v1.0," International Agency for Research on Cancer, 2012. [Online]. Available: http://publications.iarc.fr/Databases/Iarc-Cancerbases/GLOBOCAN-2012-Estimated-Cancer-Incidence-Mortality-And-Prevalence-Worldwide-In-2012-V1.0-2012.
- arrow_upward [3] Organización Mundial de la Salud and Organización Panamericana de la Salud, "Plataforma de información en salud de las Américas," OPS, 2017. [Online]. Available: .
- arrow_upward [4] A. R. Lima, M. de L. Bastos, M. Carvalho, and P. Guedes de Pinho, "Biomarker Discovery in Human Prostate Cancer: an Update in Metabolomics Studies," Transl. Oncol., vol. 9, no. 4, pp. 357–370, Aug. 2016.
- arrow_upward [5] Y. A. Goo and D. R. Goodlett, "Advances in proteomic prostate cancer biomarker discovery," J. Proteomics, vol. 73, no. 10, pp. 1839–1850, Sep. 2010.
- arrow_upward [6] R. A. Castillejos-Molina and F. B. Gabilondo-Navarro, "Prostate Cancer," Salud Publica Mex., vol. 58, no. 2, pp. 279–284, 2016.
- arrow_upward [7] Instituto Nacional del Cáncer, "Análisis del antígeno prostático específico (PSA) - National Cancer Institute." [Online]. Available: https://www.cancer.gov/espanol/tipos/prostata/hoja-informativa-psa.
- arrow_upward [8] A. Heidenreich et al., "EAU Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Treatment of Clinically Localised Disease," Eur. Urol., vol. 59, no. 1, pp. 61–71, Jan. 2011.
- arrow_upward [9] S. Loeb and W. J. Catalona, "The Prostate Health Index: a new test for the detection of prostate cancer," Ther. Adv. Urol., vol. 6, no. 2, pp. 74–77, Apr. 2014.
- arrow_upward [10] M. Lazzeri et al., "Relationship of Chronic Histologic Prostatic Inflammation in Biopsy Specimens With Serum Isoform [-2]proPSA (p2PSA), %p2PSA, and Prostate Health Index in Men With a Total Prostate-specific Antigen of 4-10 ng/mL and Normal Digital Rectal Examination," Urology, vol. 83, no. 3, pp. 606–612, Mar. 2014.
- arrow_upward [11] D. Hessels et al., "DD3PCA3-based Molecular Urine Analysis for the Diagnosis of Prostate Cancer," Eur. Urol., vol. 44, no. 1, pp. 8–16, Jul. 2003.
- arrow_upward [12] Y. Fradet et al., "uPM3, a new molecular urine test for the detection of prostate cancer," Urology, vol. 64, no. 2, pp. 311–315, Aug. 2004.
- arrow_upward [13] R. Wang, A. M. Chinnaiyan, R. L. Dunn, K. J. Wojno, and J. T. Wei, "Rational approach to implementation of prostate cancer antigen 3 into clinical care," Cancer, vol. 115, no. 17, pp. 3879–3886, Sep. 2009.
- arrow_upward [14] M. A. Álvarez-Blanco, P. M. Escudero-de los-Ríos, and H.-T. N, "Cáncer de próstata," Rev. Mex. Urol., vol. 68, no. 4, pp. 245–254, 2008.
- arrow_upward [15] M. Aalberts, T. A. E. Stout, and W. Stoorvogel, "Prostasomes: extracellular vesicles from the prostate," Reproduction, vol. 147, no. 1, pp. R1–R14, Jan. 2014.
- arrow_upward [16] J. Nilsson et al., "Prostate cancer-derived urine exosomes: a novel approach to biomarkers for prostate cancer," Br. J. Cancer, vol. 100, no. 10, pp. 1603–1607, May 2009.
- arrow_upward [17] C. Zijlstra and W. Stoorvogel, "Prostasomes as a source of diagnostic biomarkers for prostate cancer," J. Clin. Invest., vol. 126, no. 4, pp. 1144–1151, Apr. 2016.
- arrow_upward [18] F. Saez and R. Sullivan, "Prostasomes, post-testicular sperm maturation and fertility," Front. Biosci. (Landmark Ed., vol. 21, pp. 1464–73, 2016.
- arrow_upward [19] G. Ronquist, "Prostasomes are mediators of intercellular communication: from basic research to clinical implications," J. Intern. Med., vol. 271, no. 4, pp. 400–413, Apr. 2012.
- arrow_upward [20] A. G. Utleg et al., "Proteomic analysis of human prostasomes," Prostate, vol. 56, no. 2, pp. 150–161, Jul. 2003.
- arrow_upward [21] K. G. Ronquist, G. Ronquist, A. Larsson, and L. Carlsson, "Proteomic analysis of prostate cancer metastasis-derived prostasomes," Anticancer Res., vol. 30, no. 2, pp. 285–290, Feb. 2010.
- arrow_upward [22] S. A. Melo et al., "Glypican-1 identifies cancer exosomes and detects early pancreatic cancer," Nature, vol. 523, no. 7559, pp. 177–182, Jul. 2015.
- arrow_upward [23] G. Tavoosidana et al., "Multiple recognition assay reveals prostasomes as promising plasma biomarkers for prostate cancer," Proc. Natl. Acad. Sci., vol. 108, no. 21, pp. 8809–8814, May 2011.
- arrow_upward [24] D. a Sartori and D. W. Chan, "Biomarkers in prostate cancer," Curr. Opin. Oncol., vol. 26, no. 3, pp. 259–264, May 2014.
- arrow_upward [25] B. O. Nilsson, L. Carlsson, A. Larsson, and G. Ronquist, "Autoantibodies to Prostasomes as New Markers for Prostate Cancer," Ups. J. Med. Sci., vol. 106, no. 1, pp. 43–50, Jan. 2001.
- arrow_upward [26] S. Fredriksson et al., "Protein detection using proximity-dependent DNA ligation assays," Nat. Biotechnol., vol. 20, no. 5, pp. 473–477, May 2002.
- arrow_upward [27] J. Gu, L. Ren, X. Wang, C. Qu, and Y. Zhang, "Expression of livin, survivin and caspase-3 in prostatic cancer and their clinical significance.," Int. J. Clin. Exp. Pathol., vol. 8, no. 11, pp. 14034–9, 2015.
- arrow_upward [28] S. Khan et al., "Racial differences in the expression of inhibitors of apoptosis (IAP) proteins in extracellular vesicles (EV) from prostate cancer patients," PLoS One, vol. 12, no. 10, p. e0183122, Oct. 2017.
- arrow_upward [29] S. Khan, J. M. S. Jutzy, J. R. Aspe, D. W. McGregor, J. W. Neidigh, and N. R. Wall, "Survivin is released from cancer cells via exosomes," Apoptosis, vol. 16, no. 1, pp. 1–12, Jan. 2011.
- arrow_upward [30] S. Khan et al., "Plasma-Derived Exosomal Survivin, a Plausible Biomarker for Early Detection of Prostate Cancer," PLoS One, vol. 7, no. 10, p. e46737, Oct. 2012.
- arrow_upward [31] K. Gabriel et al., "Regulation of the Tumor Suppressor PTEN through Exosomes: A Diagnostic Potential for Prostate Cancer," PLoS One, vol. 8, no. 7, p. e70047, Jul. 2013.
- arrow_upward [32] X. Huang et al., "Exosomal miR-1290 and miR-375 as Prognostic Markers in Castration-resistant Prostate Cancer," Eur. Urol., vol. 67, no. 1, pp. 33–41, Jan. 2015.
- arrow_upward [33] R. J. Bryant et al., "Changes in circulating microRNA levels associated with prostate cancer," Br. J. Cancer, vol. 106, no. 4, pp. 768–774, Feb. 2012.
- arrow_upward [34] P. Filipazzi, M. Bürdek, A. Villa, L. Rivoltini, and V. Huber, "Recent advances on the role of tumor exosomes in immunosuppression and disease progression," Semin. Cancer Biol., vol. 22, no. 4, pp. 342–349, Aug. 2012.
- arrow_upward [35] M. Lundholm et al., "Prostate Tumor-Derived Exosomes Down-Regulate NKG2D Expression on Natural Killer Cells and CD8+ T Cells: Mechanism of Immune Evasion," PLoS One, vol. 9, no. 9, p. e108925, Sep. 2014.
- arrow_upward [36] A. Gámez-Valero, S. Lozano-Ramos, I. Bancu, R. Lauzurica-Valdemoros, and F. E. Borrà s, "Urinary Extracellular Vesicles as Source of Biomarkers in Kidney Diseases," Front. Immunol., vol. 6, p. 6, Jan. 2015.
- arrow_upward [37] KS. Principe et al., "In-depth proteomic analyses of exosomes isolated from expressed prostatic secretions in urine," Proteomics, vol. 13, no. 10–11, pp. 1667–1671, May 2013.
- arrow_upward [38] J. K. O. Skog, X. O. Breakefield, D. Brown, K. C. Miranda, and L. M. Russo, "Uso de microvesículas en el diagnóstico, pronóstico y tratamiento de enfermedades y afecciones médicas," 2 446 301, 2013.
- arrow_upward [39] A. Øverbye et al., "Identification of prostate cancer biomarkers in urinary exosomes," Oncotarget, vol. 6, no. 30, pp. 30357–30376, Oct. 2015.
- arrow_upward [40] R. W. Cotton and M. B. Fisher, "Review: Properties of sperm and seminal fluid, informed by research on reproduction and contraception," Forensic Sci. Int. Genet., vol. 18, pp. 66–77, Sep. 2015.
- arrow_upward [41] M. J. Roberts, R. S. Richards, R. A. Gardiner, and L. A. Selth, "Seminal fluid: a useful source of prostate cancer biomarkers?," Biomark. Med., vol. 9, no. 2, pp. 77–80, Feb. 2015.
- arrow_upward [42] A. Lo Cicero, P. D. Stahl, and G. Raposo, "Extracellular vesicles shuffling intercellular messages: for good or for bad," Curr. Opin. Cell Biol., vol. 35, pp. 69–77, Aug. 2015.
- arrow_upward [43] L. Carlsson, O. Nilsson, A. Larsson, M. Stridsberg, G. Sahlén, and G. Ronquist, "Characteristics of human prostasomes isolated from three different sources," Prostate, vol. 54, no. 4, pp. 322–330, Mar. 2003.
- arrow_upward [44] M. R. Kovak, S. Saraswati, S. D. Goddard, and A. B. Diekman, "Proteomic identification of galectin-3 binding ligands and characterization of galectin-3 proteolytic cleavage in human prostasomes," Andrology, vol. 1, no. 5, pp. 682–691, Sep. 2013.
- arrow_upward [45] A. S. Block, S. Saraswati, C. F. Lichti, M. Mahadevan, and A. B. Diekman, "Co-purification of Mac-2 binding protein with galectin-3 and association with prostasomes in human semen," Prostate, vol. 71, no. 7, pp. 711–721, May 2011.
- arrow_upward [46] M. J. Roberts et al., "Diagnostic performance of expression of PCA3, Hepsin and miR biomarkers inejaculate in combination with serum PSA for the detection of prostate cancer," Prostate, vol. 75, no. 5, pp. 539–549, Apr. 2015.
- arrow_upward [47] L. Dubois et al., "Malignant cell-derived extracellular vesicles express different chromogranin epitopes compared to prostasomes," Prostate, vol. 75, no. 10, pp. 1063–1073, Jul. 2015.
- arrow_upward [48] A. A. Babiker, G. Ronquist, B. Nilsson, and K. N. Ekdahl, "Overexpression of ecto-protein kinases in prostasomes of metastatic cell origin," Prostate, vol. 66, no. 7, pp. 675–686, May 2006.
- arrow_upward [49] J. H. Teixeira, A. M. Silva, M. I. Almeida, M. A. Barbosa, and S. G. Santos, "Circulating extracellular vesicles: Their role in tissue repair and regeneration," Transfus. Apher. Sci., vol. 55, no. 1, pp. 53–61, 2016.
- arrow_upward [50] J. J. Tosoian, H. B. Carter, A. Lepor, and S. Loeb, "Active surveillance for prostate cancer: current evidence and contemporary state of practice," Nat. Rev. Urol., vol. 13, no. 4, pp. 205–215, Apr. 2016.
- arrow_upward [51] S. P. Basourakos et al., "Baseline and longitudinal plasma caveolin-1 level as a biomarker in active surveillance for early-stage prostate cancer," BJU Int., vol. 121, no. 1, pp. 69–76, Jan. 2018.
- arrow_upward [52] T. Pellinen et al., "ITGB1-dependent upregulation of Caveolin-1 switches TGFβ signalling from tumour-suppressive to oncogenic in prostate cancer," Sci. Rep., vol. 8, no. 1, p. 2338, Dec. 2018.
- arrow_upward [53] P. Gimenez-Bonafe et al., "Multidrug resistance protein 1 localization in lipid raft domains and prostasomes in prostate cancer cell lines," Onco. Targets. Ther., vol. 7, pp. 2215–2225, Dec. 2014.
- arrow_upward [54] J. F. Renzulli et al., "Microvesicle Induction of Prostate Specific Gene Expression in Normal Human Bone Marrow Cells," J. Urol., vol. 184, no. 5, pp. 2165–2171, Nov. 2010.