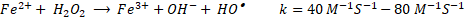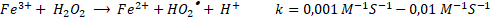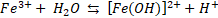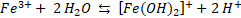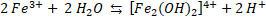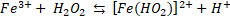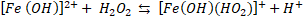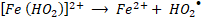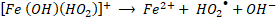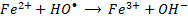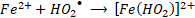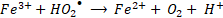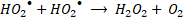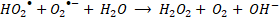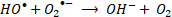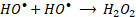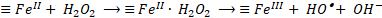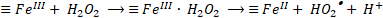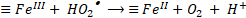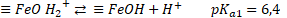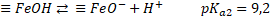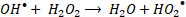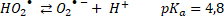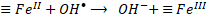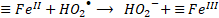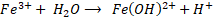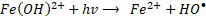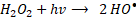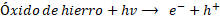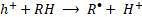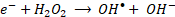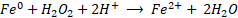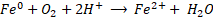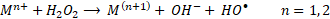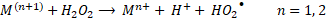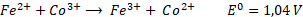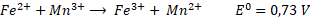Óxidos de hierro como catalizadores de procesos tipo Fenton con potencial aplicación en tecnologías de remoción de contaminantes
Iron Oxides as Catalysts of Fenton-Type Processes with Potential Application in Pollutant Removal Technologies
Recibido: 24 abril 2022
Aceptado: 24 octubre 2022
Disponible: 22 noviembre 2022
V. Garzón-Cucaita, J. G. Carriazo, “Óxidos de hierro como catalizadores de procesos tipo Fenton con potencial aplicación en tecnologías de remoción de contaminantes,” TecnoLógicas, vol. 25, nro. 55, e2393, 2022. https://doi.org/10.22430/22565337.2393
Highlights
Resumen
Existe la necesidad de diseñar nuevas tecnologías para el tratamiento de aguas residuales, con mayor eficiencia y alcance de aplicación ingenieril. Entre dichas tecnologías, los procesos avanzados de oxidación (AOP, por sus siglas en inglés) han demostrado alta eficiencia y potencial aplicación en la degradación de contaminantes peligrosos. Las reacciones Fenton y tipo Fenton constituyen el grupo de AOP de uso más extendido, debido a su gran poder oxidante y viabilidad de aplicación. Los óxidos de hierro, estables, no tóxicos y abundantes, han sido ampliamente estudiados como catalizadores de sistemas tipo Fenton. El objetivo del presente estudio fue mostrar el estado actual sobre los avances recientes en la aplicación de los óxidos de hierro como catalizadores en este tipo de sistemas. Metodológicamente, se realizó una revisión bibliográfica sistemática sobre óxidos de hierro empleados en procesos tipo Fenton, usando la base de datos Scopus con una fórmula de búsqueda que incluyó los descriptores y operadores booleanos apropiados. Como resultado, se identificó, clasificó y analizó una amplia variedad de estructuras con diferentes características y desempeño catalítico. En conclusión, las especies más estudiadas como catalizadores han sido magnetita (Fe3O4), hematita (α-Fe2O3), goethita (α-FeOOH) y ferrihidrita (FeOOH), mostrando diferentes niveles de degradación de contaminantes orgánicos, dependiendo del tipo de sustrato, pH, temperatura y concentración de H2O2. Además, se describieron algunas modificaciones enfocadas a mejorar su eficiencia catalítica: empleo de radiación UV-Vis, incorporación de Fe metálico (Fe0) o metales de transición (Co, Cu y Mn), soportes catalíticos y control de la morfología de partículas.
Palabras clave: Catalizador heterogéneo, óxido de hierro, proceso avanzado de oxidación, reacción Fenton, tecnología de remoción de contaminante.
Abstract
The designing of new technologies for wastewater treatment is needed. These procedures should have greater efficiency and broad engineering application scope. Among these technologies, the advanced oxidation processes (AOP) have shown high efficiency and potential application in the degradation of hazardous pollutants. Fenton and Fenton-type reactions constitute the most widely used group of AOPs, due to their great oxidizing power and feasibility of application. The iron oxides are stable, non-toxic, and abundant; they have been extensively studied as catalysts for Fenton-type systems. The aim of this work is to show the state of the art on the application of iron oxides as catalysts in these systems. Methodologically, a systematic bibliographic review was carried out on the iron oxides used in Fenton-type processes, using the Scopus database with a search formula that included the appropriate descriptors and boolean operators. As a result, a wide variety of structures with different characteristics and catalytic performance were identified, classified, and analyzed. As conclusion, the most studied species like heterogeneous Fenton catalysts have been magnetite (Fe3O4), hematite (α-Fe2O3), goethite (α-FeOOH) and ferrihydrite (FeOOH). They show different levels of degradation of organic contaminants, depending on the type of substrate, pH, temperature, and concentration of H2O2. In addition, some modifications focused on improving the catalytic efficiency were described: the use of UV-Vis radiation, incorporation of metallic Fe (Fe0) or transition metals (Co, Cu and Mn), catalytic supports, and the control of particle morphology.
Keywords: Heterogeneous catalyst, iron oxide, advanced oxidation process, Fenton reaction, pollutant removal technology.
1. INTRODUCCIÓN
El agua es el componente más importante y esencial para diversas especies, para el medio ambiente y los seres humanos [
Un proceso de purificación de aguas generalmente consiste en varios pasos sucesivos, que involucran diferentes procedimientos físicos y/o biológicos de sedimentación, floculación, coagulación, filtración, degradación con microorganismos, entre otros [
Algunas ventajas de estos procedimientos incluyen su facilidad de implementación, ya que no requieren equipos sofisticados o de difícil operación, con lo cual son viables económicamente. Sin embargo, en los tratamientos físicos, como la adsorción, los contaminantes no se degradan, sino que se concentran o se transfieren a otras fases, generando así material de desecho secundario, lo que constituye una gran desventaja en su aplicación [
Los AOP, propuestos por primera vez en 1987 [
Las especies reactivas de oxígeno (ROS, por sus siglas en inglés) representan oxidantes fuertes que pueden iniciar los AOP para degradar contaminantes a moléculas simples y no tóxicas. Los radicales libres son átomos o moléculas que contienen al menos un electrón desapareado, como el radical hidroxilo (HO•), el radical anión superóxido (O2•-), el radical perhidroxilo (HO2•) o el radical alcoxilo (RO•) [
Con el fin de generar radicales activos de manera más eficiente y mejorar las características de las tecnologías basadas en AOP, se han adoptado diferentes métodos de activación, entre ellos los que involucran adición de metales de transición. Dada su alta eficiencia y fácil control, dichos métodos han generado gran impacto y se han estudiado exhaustivamente [
Entre los AOP que han empleado óxidos de hierro, el proceso Fenton se ha considerado como el método más potente, eficaz, energéticamente eficiente, rentable y menos tedioso para usarse como alternativa en el tratamiento de aguas contaminadas con compuestos orgánicos (Figura 1). Estos procesos no requieren equipos sofisticados o reactivos costosos y son ecológicamente viables [
De manera general, se discuten las condiciones de reacción y las características diferenciales entre los principales óxidos de hierro. Además, se informan los avances más relevantes que han conseguido mejoras en la eficiencia de los procesos tipo Fenton, destacando la importancia de los métodos de síntesis y de caracterización de los catalizadores.
2. METODOLOGÍA
La revisión bibliográfica se realizó empleando la base de datos Scopus, para lo cual se emplearon los siguientes descriptores conectados mediante operadores booleanos (OR, AND): (“Fenton reaction” OR “Fenton process” OR “Fenton system” OR “Fenton-type reaction” OR “Fenton-like reaction” OR “Fenton-type process” OR “Fenton-like process” OR “Fenton-type system” OR “Fenton-like system” OR “Advanced Oxidation processes”) AND ("iron oxide" OR "iron oxides" OR "iron species" OR "iron hydroxide" OR "iron oxyhydroxide"). Los descriptores empleados fueron previamente validados en www.sciencedirect.com/topics. Dentro de los criterios de búsqueda se solicitó que los descriptores se localizaran como parte del título, el resumen y las palabras clave de los documentos (Article title, abstract, Keywords). La búsqueda se enmarcó cronológicamente entre los años 2000 y 2021. Esta exploración inicialmente arrojó 1163 documentos (Figura 2a), 12 documentos secundarios (no disponibles directamente en Scopus) y 611 patentes. Todos los documentos se clasificaron inicialmente por áreas (se escogieron las áreas de conocimiento con porcentajes de documentos iguales o superiores al 9 % (Figura 2b), para luego realizar la filtración de documentos y obtener sólo artículos de investigación, reviews (artículos de revisión) y capítulos de libro (Figura 2c).
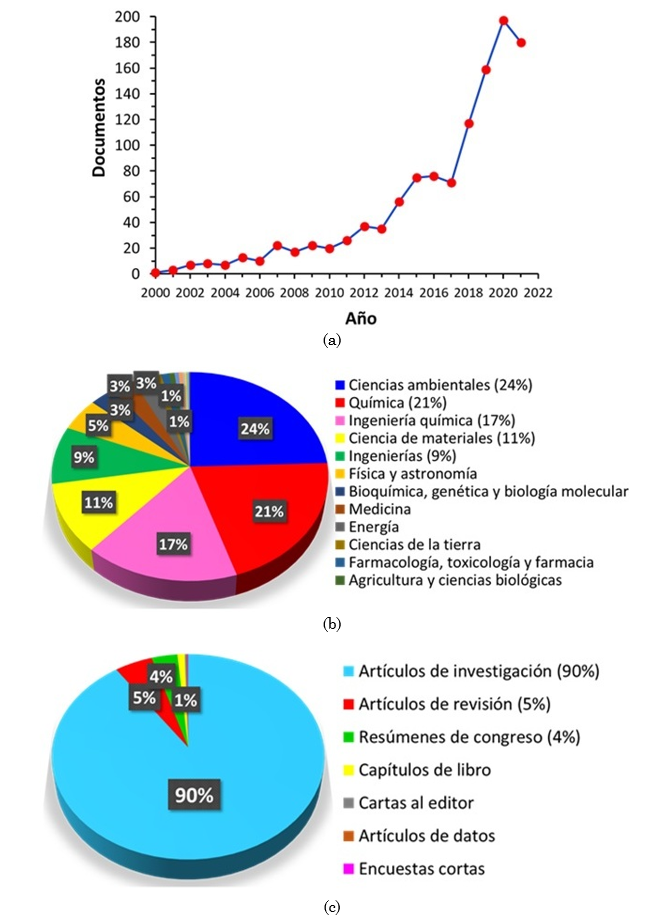
Posteriormente, el material bibliográfico se seleccionó de acuerdo con la información proporcionada en el título de cada documento. Luego de esta selección, el volumen de documentos se redujo ostensiblemente para revisar los abstracts. La revisión de los resúmenes permitió finalmente seleccionar un número reducido, pero importante, de alrededor de 160 artículos (de investigación y de revisión) que fueron totalmente leídos y analizados para alcanzar la redacción del presente artículo. La Figura 2 muestra algunos resultados relevantes de la búsqueda en Scopus. Según ello, es evidente el número creciente de publicaciones científicas, en los últimos años, relacionadas con la reacción Fenton catalizada por óxidos de hierro.
Además de la selección realizada mediante Scopus, se revisaron artículos clásicos sobre la temática estudiada, publicados antes del año 2000. También se revisaron artículos conocidos previamente por los autores y que no fueron localizados por el motor de búsqueda, por no hacer parte de la base Scopus.
3. RESULTADOS
3.1 Estudio del sistema Fenton
3.1.1 Sistema Fenton convencional
En la reacción de Fenton clásica, el peróxido de hidrógeno (H2O2) y los iones ferrosos (Fe2+) (reactivos de Fenton) se ponen en contacto en una disolución acuosa a pH ácido, presión atmosférica y temperatura ambiente [
Los sitios activos en el proceso Fenton se derivan de iones Fe2+, que sirven como catalizadores para descomponer las moléculas de H2O2 en numerosos radicales hidroxilos (HO•) [
El estudio de un modelo cinético referente a la descomposición de H2O2 por iones Fe3+ en solución acuosa homogénea [
Estos autores encontraron dependencia de la velocidad de descomposición de H2O2, en determinadas condiciones de pH, con las concentraciones iniciales de Fe(III) y de H2O2, así como también con la proporción molar entre ellas.
La existencia de las diferentes especies de Fe(III) en el medio de reacción es consecuencia del pH y del potencial redox. Se ha encontrado que Fe3+ es la especie predominante a pH < 2, mientras que los complejos Fe(III)-hidroxi ([Fe(OH)]2+, [Fe(OH)2]+, [Fe2(OH)2]4+) están presentes a pH > 2 [
Con respecto a la concentración inicial de H2O2, el comportamiento de la reacción varía entre intervalos. En un estudio cinético [
En general, la reacción de Fenton es rápida al principio, por la presencia de más radicales HO• a pH bajo, pero se ralentiza gradualmente conforme se producen radicales HO2•. Es decir que, la reacción tipo-Fenton (2) es más lenta que la reacción Fenton (1), por lo cual, los iones Fe3+ actúan como captadores de radicales y se precipitan en forma de lodos de Fe(OH)3 en el sistema [
Por lo tanto, se han desarrollado óxidos y oxihidróxidos de hierro, minerales de hierro modificados, materiales a base de hierro soportado, etc., como catalizadores sólidos para el proceso Fenton heterogéneo [
3.1.2 Sistema Fenton heterogéneo
En el proceso tipo Fenton frecuentemente se utilizan catalizadores sólidos para reemplazar el Fe2+ disuelto [
Fuente: Elaboración propia.
| Óxido de hierro empleado | Carga de catalizador (g/L) | Contaminante modelo | pH | Porcentaje de degradación (%) | Tiempo (h) | Ref. |
| Fe3O4 | 1 | Alacloro | 4 | 69,5 | 0,3 | [ |
| Fe3O4 | 1 | 2,4 Diclorofenol | 3 | 100 | 3 | [ |
| Fe3O4 | 6 | Paracetamol | 2,6 | 100 | 5 | [ |
| Fe3O4 | 0,3 – 0,5 | Azul de metileno | 3 | 100 | 0,3 | [ |
| Óxido de hierro (II/III) | 2 | Rodamina B | 7 | – | – | [ |
| Fe3O4 | 3 | Fenol | 7 | 42 – 65 | 24 | [ |
| Fe3O4 | 5 | Fenol Anilina | 6 – 7 | 100 | 6 | [ |
| α-FeOOH | 1 | 2,4,4′-triclorobifenilo (PCB28) | 3 | 99 | 48 | [ |
| α-FeOOH | 0,3 | Naranja de metilo | 3 | 99 | 1,2 | [ |
| α-FeOOH | 2,5 | Naranja de metilo | 7 | 100 | 1,3 | [ |
| α-FeOOH | 0,3 | Naranja ácido 7 | 3 | 99,5 | 0,5 | [ |
| α-FeOOH | 0,2 | 2-Clorofenol | 3 | 100 | 4 – 6 | [ |
| α-FeOOH | 0,5 | 2-Clorofenol | 3 | 98,5 | 4 | [ |
| Fe2O3 | 1 | Fenol | 5 | 84 | 2 | [ |
| Fe-Fe2O3 Fe-Fe2O3/Fe2+ | 0,5 | Rodamina B | – | 18 80 | 0,5 | [ |
| Fe2O3/Fe2+ | 0,4 | Rodamina B Azul de metileno Violeta de metilo | 4,7 | 100 | 0,5 | [ |
Las reacciones Fenton heterogéneas, representadas en la Figura 3, suelen estar controladas por procesos cinéticos que incluyen la adsorción de reactivos, la reacción química en la superficie del catalizador y la desorción del producto [
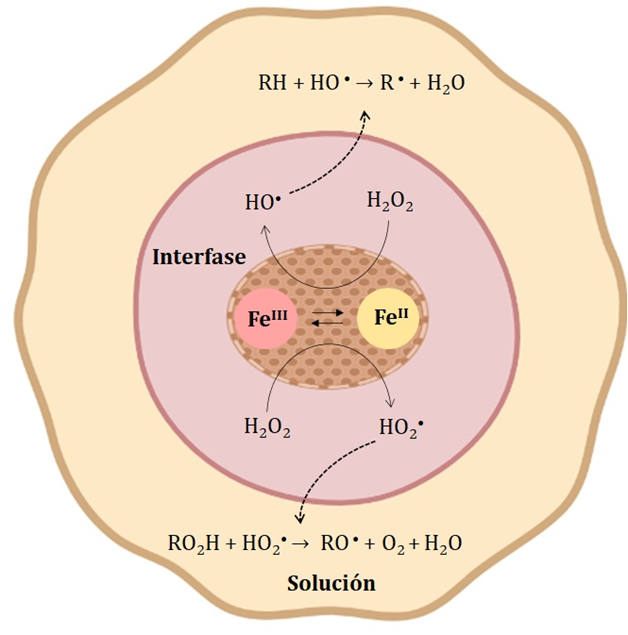
Para el mecanismo en superficie, en primer lugar, debe ocurrir la difusión y adsorción de H2O2 en la superficie del óxido. En este punto ocurre la formación de un complejo entre H2O2 y las especies de hierro en superficie (≡FeIII y/o ≡FeII). Posteriormente, una transferencia electrónica intramolecular en el complejo genera la formación de radicales hidroxilos (HO•) y ≡FeII (18) y radicales perhidroxilos (HO2•) y ≡FeII (19). Finalmente, los radicales HO2• formados pueden causar la regeneración de ≡FeII (20). De este modo, la descomposición de H2O2 es catalizada principalmente por el ≡FeII para generar el radical HO•. Al mismo tiempo, ≡FeII se oxida a ≡FeIII, formando un ciclo del estado del hierro en la superficie del óxido [
Los radicales generados pueden reaccionar con los compuestos orgánicos adsorbidos en la vecindad de especies de hierro activas u oxidar los compuestos orgánicos no adsorbidos cerca de la región de interfase entre la superficie del catalizador y la disolución [
Algunos sistemas Fenton heterogéneos se caracterizan por un comportamiento cinético de degradación en dos etapas, un período inicial de inducción lenta y uno posterior de oxidación rápida. Los investigadores postulan que el período de inducción incluye la lixiviación de hierro superficial y la catálisis heterogénea, y que la segunda etapa comprende reacciones Fenton homogéneas inducidas por el hierro lixiviado [
3.2 Óxidos de hierro empleados en procesos tipo Fenton
Los óxidos y oxihidróxidos de hierro son minerales naturales comunes, que están muy extendidos en la corteza terrestre y se preparan fácilmente en el laboratorio [
3.2.1 Magnetita (Fe3O4)
La magnetita es un óxido de hierro con estructura tipo espinela inversa y fórmula química (Fe3+)tet[Fe2+Fe3+]octO4 donde los cationes Fe3+ ocupan por igual los sitios octaédricos y tetraédricos y los cationes Fe2+ se posicionan únicamente en los sitios octaédricos de la celda unitaria, se diferencia de la mayoría de los otros óxidos de hierro en que contiene el metal en sus estados de oxidación II y III [
- Es un óxido de hierro que contiene Fe(II) en su estructura [
33 ]. Estas especies Fe2+ desempeñan un papel importante como donantes de electrones para iniciar la reacción de Fenton, mejorando la producción de radicales hidroxilo [56 ]. -
La presencia de sitios octaédricos en su estructura, donde se ubican especies tanto de Fe2+ como de Fe3+, lo que significa que el hierro puede oxidarse y reducirse reversiblemente en la misma estructura [
56 ]. -
La separación fácil de los catalizadores de magnetita del sistema de reacción como resultado de sus propiedades magnéticas [
57 ]. - La posibilidad de sustituir isoestructuralmente el hierro por diferentes metales de transición, lo cual permite ajustar las propiedades fisicoquímicas de las magnetitas para producir sistemas más activos [
33 ].
Otros autores [
En este mismo estudio, los autores reportaron el efecto de la temperatura en la degradación del medicamento, encontrando que un aumento en la temperatura (de 30 ºC a 60 ºC) promueve la tasa de formación de radicales HO• según la ley de Arrhenius, exhibiendo un efecto beneficioso para todas las condiciones investigadas. En varios casos se ha informado de la tendencia de las nanopartículas de magnetita a aglomerarse, lo cual bloquea los sitios activos haciéndolos inaccesibles. En ese caso, los radicales HO• son consumidos a través de reacciones secundarias indeseables [
Estos hallazgos coinciden con los informados por otros investigadores [
Los óxidos tipo magnetita se han modificado con el fin de aumentar el valor de la relación FeII/FeIII. Al respecto, se ha usado óxido de hierro (II, III) obtenido mediante un pretratamiento de reducción, y magnetita convencional en la degradación de fenol a pH neutro [
Adicionalmente, otros elementos como el titanio se han incorporado en la estructura de la magnetita para formar compuestos tipo Fe3-xTixO4. Por ejemplo, investigadores usaron el material que llamaron titanomagnetita como catalizador en la degradación tipo Fenton de azul de metileno [
Otros autores han usado agentes reductores durante la reacción de Fenton catalizada por magnetita, estudiando el sistema Fe3O4/AA/H2O2 (AA: ácido ascórbico) en la eliminación de alacloro a pH inicial de 4 [
Los agentes reductores, como AA, pueden interactuar con las especies ≡FeIII en la superficie del óxido, formando complejos (≡FeIII)(AA), siguiendo con una transferencia de electrones para generar especies ≡FeII y el agente oxidado. Estas especies ≡FeII bien pueden catalizar la reacción heterogénea de Fenton o pueden liberarse a la solución en forma de iones Fe2+ y promover el proceso homogéneo. En otros estudios se ha informado de la disolución reductiva de óxidos de hierro por acción de AA [
Sin embargo, se observó que el AA se consumió rápidamente debido a su oxidación, principalmente por acción de los radicales HO•. Por otra parte, investigadores establecieron un modelo bastante interesante, discriminando los HO• generados en superficie de aquellos generados en los procesos homogéneos [
Los experimentos que han estudiado el efecto del pH en la reacción de Fenton catalizada por magnetita coinciden en que las condiciones ácidas provocan tiempos de inducción cortos y mayor velocidad de reacción, mientras que con valores de pH básicos se observan tasas de degradación lentas [
Los principales inconvenientes en el uso de magnetita como catalizador tipo Fenton se relacionan con su inestabilidad en condiciones oxidantes, especialmente cuando exhibe tamaños de partícula nanométricos. En esas condiciones, se ha demostrado que se convierte en maghemita en presencia de H2O2, comenzando desde la superficie y avanzando hasta el núcleo de la partícula [
3.2.2 Goethita (α-FeOOH)
La goethita es uno de los oxihidróxidos de hierro más estables termodinámicamente, posee una estructura ortorrómbica, cuyo empaquetamiento posee aniones O2− y OH− con Fe3+ en el centro de huecos octaédricos [
Otros investigadores utilizaron exitosamente un catalizador de goethita en la degradación tipo Fenton de dimetilsulfóxido (DMSO) [
Así mismo, otros autores estudiaron la degradación de bisfenol A (BPA) en una suspensión de goethita, encontrando que la reacción es más rápida en medio ácido [
Algunos investigadores han dado detalles del mecanismo de reacción de la goethita en el sistema Fenton. Se utilizó el 2-clorofenol (2-CP) como contaminante modelo y se estudió el efecto de la goethita con diferentes tamaños de partícula sobre la eficiencia de oxidación bajo el pH inicial de 3 [
El proceso de disolución de la goethita puede ser reductivo o no, además la presencia de ligantes o agentes reductores incrementa su velocidad. El uso de ligantes oxalato ha demostrado un aumento sustancial en la disolución de goethita [
Otros autores han estudiado la dependencia de la temperatura en estos sistemas. Entre ellos, la oxidación de 2-clorofenol por peróxido de hidrógeno en presencia de goethita en un intervalo de 25 ºC a 50 ºC [
La primera involucra la disolución de la goethita y la oxidación del 2-clorofenol por un mecanismo heterogéneo. En la segunda etapa predomina la reacción del 2-clorofenol con los radicales hidroxilos producidos por la reacción con especies de hierro disueltas. Además, los autores confirmaron que la disolución de la goethita es un proceso endotérmico.
Con respecto a la concentración de catalizador, aunque algunos estudios coinciden en que la tasa de eliminación de contaminantes orgánicos mejora al aumentar la adición de goethita [
De esta manera, se ha considerado que, en la reacción de Fenton catalizada por goethita, en condiciones ácidas, el compuesto sólido actúa en gran medida como fuente de iones hierro, que se disuelven en el medio líquido y posteriormente el proceso se comporta como un Fenton homogéneo. Por otro lado, con valores de pH entre 6 y 9, el proceso es solamente heterogéneo; es decir, el hierro actúa exclusivamente en el sólido y está unido permanentemente a él o, en una reacción pseudo-heterogénea, se adsorbe y desorbe de la superficie en un ciclo continuo [
3.2.3 Hematita (α-Fe2O3)
La hematita es el óxido de hierro más estable en condiciones ambientales. Sus aplicaciones se derivan de sus propiedades físicas y químicas deseables, que pueden adaptarse a diversas morfologías, dimensiones de partículas y características superficiales [
Otros autores obtuvieron nanocables tipo Core-Shell Fe-Fe2O3 y usaron exitosamente dicho material en un sistema Fe-Fe2O3 /Fe2+/H2O2 para la degradación de rodamina B, eliminando el 80 % del contaminante en 30 minutos, a un pH inicial de 4,3 [
Adicionalmente, otros autores emplearon nanoplacas y nanovarillas de hematita en la degradación tipo Fenton de rodamina B, azul de metileno y violeta de metilo, demostrando que los iones ferrosos confinados en caras específicas de la estructura del catalizador pueden promover significativamente la descomposición de H2O2 para producir radicales HO• [
3.2.4 Ferrihidrita (FeOOH)
La ferrihidrita, la forma menos cristalina de la familia de los oxihidróxidos de hierro es una de las fases secundarias más comunes en condiciones neutras o ligeramente ácidas presentes en numerosos entornos. Exhibe propiedades importantes, como la capacidad de adsorción de contaminantes orgánicos e inorgánicos, debido a su área superficial y reactividad [
Algunos autores han publicado el uso del sistema H2O2/ferrihidrita en la degradación de contaminantes orgánicos. Por ejemplo, se estudió la oxidación de atrazina a diferentes valores de pH y concentraciones de H2O2 y ferrihidrita, encontrando que la reacción fue diez veces más rápida a pH 3 que a pH 8 [
3.3 Comparación entre óxidos de hierro
Algunos estudios se han enfocado en la comparación de los óxidos de hierro como catalizadores del proceso Fenton. Investigadores evaluaron el rendimiento catalítico de cuatro óxidos de hierro en la degradación tipo Fenton del 2,4,4′-triclobifenilo (PCB28) a pH 3 [
Otros autores degradaron 2,4,6-trinitrotolueno empleando diferentes óxidos de hierro y varios métodos de oxidación [
Un estudio para comparar la actividad catalítica de óxido de hierro (III) amorfo, maghemita, magnetita y goethita mezclados con cuarzo fue realizado por un grupo de investigadores [
Como se ha visto, el desempeño catalítico de los óxidos de hierro difiere substancialmente entre estructuras y características superficiales. Sin embargo, algunas observaciones con respecto al efecto de la concentración y consumo de H2O2 y a la carga de catalizador han sido un factor común entre las investigaciones.
3.3.1 Efecto de la concentración de H2O2
En general, se observa una eliminación lenta de los contaminantes acompañada de una descomposición rápida de H2O2, este efecto ya se había mencionado para el caso de la goethita, sin embargo, puede extenderse a los demás óxidos de hierro. Con el aumento de la concentración de H2O2 no se observa un incremento destacable en la degradación de los contaminantes orgánicos. Contrario a esto, cuando la concentración de H2O2 es muy alta, ocurre un fenómeno de inhibición de la descomposición de la molécula orgánica [
Este efecto se explica por la fuerte competencia hacia el consumo de HO• por parte de otras especies no objetivo, como el mismo H2O2 (24), que a su vez genera especies oxidantes como HO2•/O2•− (25), pero que poseen potenciales mucho más bajos [
3.3.2 Efecto de la concentración de catalizador
Con respecto a la concentración de catalizador, el aumento en la adición de óxido de hierro, en principio, acorta los tiempos de inducción, debido a un mayor número de sitios activos (18) y (19) y conduce al incremento en la velocidad de degradación de las moléculas orgánicas [
3.3.3 Efecto del pH
El valor de pH óptimo de 3 es una condición comúnmente extendida en la mayoría de las publicaciones referentes a las reacciones Fenton y tipo-Fenton [
3.3.4 Efecto de la temperatura
Las reacciones tipo Fenton pueden acelerarse elevando la temperatura, lo que mejora la tasa de generación de HO• y, por lo tanto, la eliminación de contaminantes. Sin embargo, a medida que las temperaturas aumentan por encima de un cierto valor (generalmente 40 °C - 50 °C), la eficiencia de la utilización de H2O2 disminuye [
3.3.5 Efecto de las Especies Reactivas de Oxígeno (ROS)
A pesar de la notoria atención sobre el radical HO• y de que se asume que éste es el principal intermediario responsable de la degradación de compuestos orgánicos, algunos autores han encontrado que tanto el radical hidroxilo (HO•) como también el radical anión superóxido (O2•-) y el radical perhidroxilo (HO2•) son responsables de la degradación de moléculas orgánicas [
Las reacciones entre HO• y compuestos orgánicos incluyen la abstracción de átomos de H de enlaces C–H, N–H y O–H, y la adición de OH a enlaces insaturados como C=C o anillos aromáticos [
3.4 Estrategias para mejorar la eficiencia del ciclo FeIII/FeII
En la mayoría de los catalizadores heterogéneos el hierro existe principalmente con número de oxidación +3, esto es, como FeIII. Como se ha visto, en la reacción de Fenton heterogénea tradicional, el ciclo redox de FeIII/FeII generado por H2O2 es fundamental. Además, en comparación con las reacciones entre Fe2+(ac)/FeII y H2O2, la reducción de Fe3+(ac)/FeIII por H2O2 es el paso que limita la velocidad. Por lo tanto, el tema central es, cómo acelerar el ciclo redox de FeIII/FeII y promover la eficiencia de utilización del H2O2 en las reacciones tipo Fenton heterogéneas tradicionales. Ello motiva a los investigadores a diseñar catalizadores y estrategias de reacción de Fenton heterogéneas más efectivas [
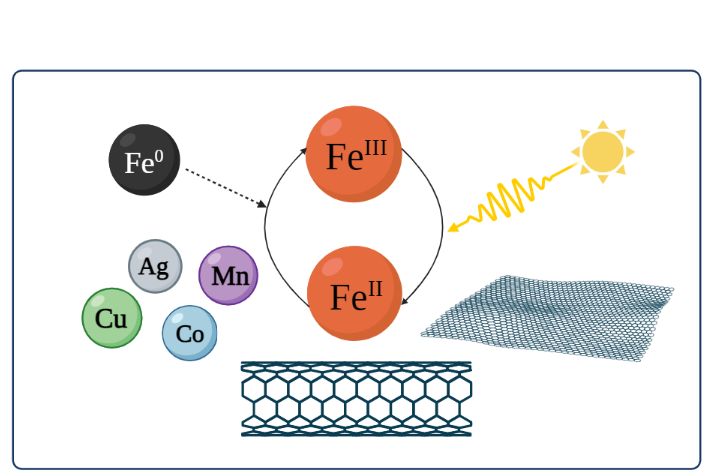
3.4.1 Sistema foto-Fenton
El proceso foto-Fenton es otra modificación del proceso clásico de Fenton que se ha llevado a la práctica actual del tratamiento de efluentes industriales [
Por otro lado, algunos catalizadores tipo Fenton heterogéneos a base de hierro también son semiconductores y pueden excitarse para producir electrones fotogenerados y huecos bajo la irradiación de luz (31), lo que da paso a reacciones con moléculas orgánicas y H2O2 para producir ROS (32) y (33). Algunos autores encontraron que, después de introducir luz solar simulada, la actividad foto-catalítica tipo Fenton para hematita, goethita, wüstita y magnetita mejoraron significativamente [
Dentro de los óxidos de hierro, la hematita ha llamado mucho la atención como catalizador foto-Fenton, debido a su alta capacidad de absorción de luz (alrededor del 43 %) en la región de luz visible. Este óxido de hierro es un semiconductor tipo n, con un band-gap de 2,1 eV, lo que lo convierte en un candidato prometedor para su posible aplicación en el tratamiento de aguas residuales bajo irradiación con luz visible [
Otros estudios han hecho uso de metales nobles, como Ag, Au, Pt, debido a su gran potencial para mejorar el rendimiento fotocatalítico de materiales con el uso de luz visible, mediante mejoras en la transferencia de electrones. Así, la síntesis de mesocristales de Ag/hematita permitió obtener alta actividad catalítica en la degradación foto-Fenton de rodamina B, naranja de metilo y glifosato [
Por otra parte, otros autores estudiaron el efecto de la adición de ácidos orgánicos y del pH de la solución inicial sobre la fotodegradación de BPA en un proceso tipo foto-Fenton, utilizando goethita como catalizador [
Una de las estrategias que se han empleado para aumentar la actividad catalítica en los sistemas foto-Fenton ha sido soportar óxidos de hierro en materiales semiconductores como el dióxido de titanio (TiO2), que es un fotocatalizador ampliamente usado, estable y muy eficiente. Estudios han demostrado que los electrones fotogenerados, transferidos de TiO2 a especies de hierro, pueden promover la reducción de ≡FeIII a ≡FeII [
3.4.2 Uso de Fe0 (ZVI)
El uso de hierro con valencia cero (ZVI, por sus iniciales en inglés) ha sido estudiado en procesos Fenton debido a su capacidad como reductor inocuo y de bajo costo (Fe2+/Fe0, E0 = − 0,44 V) [
Un grupo de investigadores diseñaron un sistema Fenton heterogéneo de Fe0/Fe3O4, obtenido mediante la reducción controlada de magnetita y lo aplicaron a la degradación de azul de metileno [
3.4.3 Incorporación de metales
Muchos estudios han demostrado que la inserción de algunos metales en la estructura de los óxidos de hierro puede promover significativamente la reactividad de dichos óxidos en las reacciones tipo Fenton [
El estudio del efecto de incorporar cationes de Co y Mn en la estructura de la magnetita permitió encontrar mejoras notables en la reactividad Fenton del óxido [
Otros autores han encontrado que la goethita dopada con cationes de Cu incrementa su actividad catalítica en el sistema foto-Fenton [
3.4.4 Uso de materiales de carbono
Debido a su bajo costo, existencia ubicua en entornos naturales, abundancia electrónica, etc., los materiales carbonáceos se han usado en combinación con óxidos de hierro, ya que no sólo pueden mejorar la transferencia de electrones, sino que también pueden aliviar la aglomeración de partículas [
Resultados experimentales mostraron que la magnetita soportada en nanotubos de carbono (CNTs: carbon nanotubes) tiene una excelente actividad catalítica en la reacción tipo Fenton para la degradación de sulfonamidas, debido a su estructura porosa, magnetismo fuerte y un excelente modo de combinación de los CNTs con las partículas de Fe3O4 [
Los resultados catalíticos mejorados con el uso de estos materiales de carbono pueden deberse a varios factores. El área superficial y su estructura porosa proporcionan una dispersión adecuada a los óxidos soportados, lo que, en primer lugar, favorece el contacto entre los reactivos y los sitios activos [
3.4.5 Control de la morfología
La morfología de los materiales sólidos está íntimamente relacionada con su configuración y coordinación atómica superficial, por lo tanto, tiene gran influencia en las propiedades físicas y químicas [
Así mismo, se han investigado las propiedades fotocatalíticas de óxidos de hierro tipo hematita con diferentes morfologías. Un grupo de autores, sintetizaron estructuras tipo croissant, tipo “erizo” y microesferas texturizadas de α-Fe2O3 mediante tratamiento hidrotérmico, que utilizaron como catalizadores heterogéneos en la fotodegradación de naranja de metilo [
Se han obtenido otras morfologías bastante particulares a partir de tratamientos hidrotérmicos. Xiao et al. [
3.5 Síntesis y caracterización de óxidos de hierro
Como se ha destacado en las secciones anteriores, las características de los catalizadores (óxidos de hierro) empleados en procesos tipo Fenton son fundamentales e influyen directamente en la eficiencia de las reacciones. Teniendo en cuenta esto, es apenas lógico revisar los métodos utilizados para la preparación de estos catalizadores, los cuales juegan un papel crítico en la estructura química, morfología, tamaño, composición, propiedades de superficie y desempeño catalítico de los materiales obtenidos [
3.5.1 Método de precipitación
El método de precipitación es la forma más común y sencilla de síntesis de óxidos de hierro. Generalmente produce precipitados de oxihidróxidos de hierro a partir de soluciones acuosas de sales de hierro, añadiendo un precipitante alcalino [
3.5.2 Método de impregnación
El método de impregnación es un enfoque de síntesis ampliamente utilizado para catalizadores soportados. Normalmente, el precursor de metal activo se disuelve en una disolución acuosa u orgánica. A continuación, el soporte del catalizador se sumerge en esa solución. Mientras tanto, el precursor activo se adsorbe gradualmente en la superficie del soporte o penetra en sus poros impulsado por la acción capilar [
3.5.3 Método hidrotérmico
El método hidrotérmico es un enfoque versátil para producir catalizadores cristalinos de alta pureza [
3.5.4 Método sol-gel
El método sol-gel es otra técnica química utilizada para la obtención de catalizadores de hierro, debido a su buen control de la composición química y la distribución del tamaño de partícula de los productos. El procedimiento de síntesis incluye varias etapas. La primera de solvólisis, en la que un alcóxido o haluro metálico se hidroliza para generar un hidróxido metálico. El producto resultante de este paso es lo que se denomina “sol”. Posteriormente, ocurre la condensación, que produce la red entrelazada metal-oxígeno-metal conocida como “gel” [
3.5.5 Método de precipitación – deposición
La precipitación–deposición es una técnica mediante la cual un precursor catalíticamente activo puede fijarse a un soporte en suspensión [
3.5.6 Caracterización de óxidos de hierro
La caracterización de los catalizadores a base de hierro es indispensable para obtener información completa con respecto a su composición, estructura y otras propiedades fisicoquímicas y con ello, comprender la relación entre las características de los sólidos y su actividad catalítica. Además, las técnicas de caracterización son herramientas bastante útiles para dar explicación a los mecanismos y fenómenos químicos que ocurren durante las reacciones tipo Fenton, de esa manera, son fuente de hallazgos que pueden contribuir al diseño de catalizadores más eficientes.
Las técnicas que se emplean comúnmente en la caracterización de óxidos de hierro se presentan en la Figura 5. Para identificar la estructura cristalina de los sólidos se usa la Difracción de Rayos X (XRD), con dicha técnica se obtiene información sobre la microestructura (tipo de celda, parámetros de red, cristalinidad y tamaño de partícula para sólidos nanométricos) de la fase que constituye el catalizador.
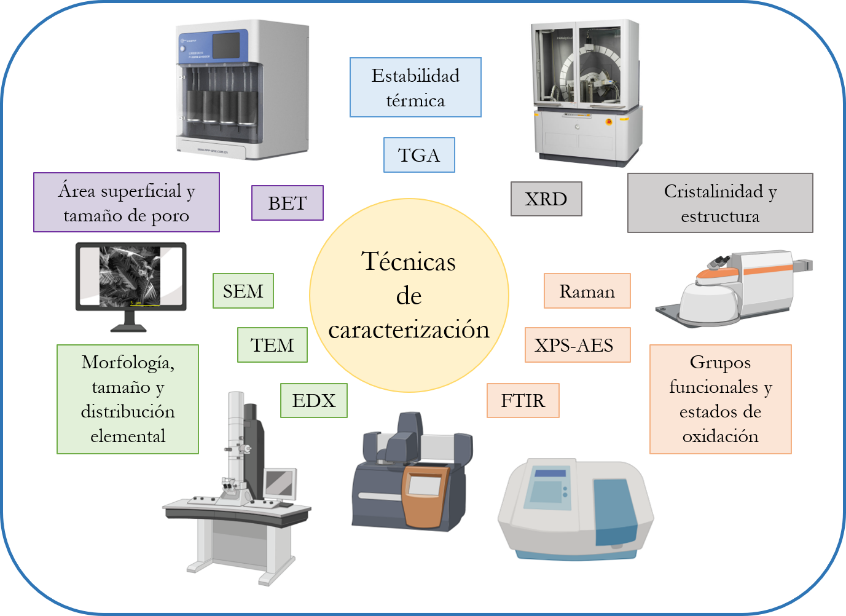
En la reacción de Fenton heterogénea, el rendimiento catalítico de los catalizadores a base de hierro tiene una estrecha relación con su área superficial específica y su naturaleza porosa. En general, una mayor área de superficial y pequeños tamaños de poro proporcionan más disponibilidad de sitios activos expuestos, lo que contribuye a una mejor capacidad de adsorción y rendimiento catalítico [
Para llevar a cabo el estudio de la morfología y el tamaño de las partículas de los catalizadores se emplean la Microscopía Electrónica de Barrido y la Microscopía Electrónica de Trasmisión (SEM y TEM). Estas técnicas permiten, a partir de la interacción de un haz de electrones con una muestra del sólido, la obtención de imágenes (micrografías) en las que se puede observar la forma de las partículas, además se puede obtener información sobre la composición de la superficie (Energía Dispersiva de Rayos X: EDX) y sobre la microestructura del material (difracción de electrones).
Por otra parte, la Espectroscopía de Fotoelectrones de rayos X (XPS) y la Espectroscopía Electrónica Auger (AES), son técnicas que proporcionan información química de la superficie de los materiales, útil para el conocimiento de los estados de oxidación de las especies contenidas en el entorno superficial del sólido. Además, las Espectroscopías IR (FTIR) y Raman son herramientas útiles para la detección de óxidos de hierro y sus modificaciones mediante enlace covalente, a través de la aparición de bandas debidas a las vibraciones de Fe-O y Fe-OH. Adicionalmente, puede evaluarse la estabilidad térmica de los óxidos de hierro y el contenido de hidroxilos de la superficie de dichos materiales través del Análisis Termogravimétrico y la Calorimetría de Barrido Diferencial (TGA y DSC, por sus siglas en inglés).
3.6 Aplicación de procesos Fenton a contaminantes orgánicos
Teniendo en cuenta el uso potencial de los óxidos de hierro como catalizadores tipo Fenton, es prudente resaltar brevemente los principales grupos de contaminantes orgánicos que se han degradado a través de este sistema de reacción.
3.6.1 Colorantes
Los colorantes orgánicos son un grupo de moléculas bastante estables y se utilizan ampliamente en industrias químicas y afines, como la textil, cosmética, alimentaria, del cuero, del papel, farmacéutica, de plásticos, etc. Alrededor de 7×107 toneladas de colorantes sintéticos se producen anualmente para la industria textil en todo el mundo, de las cuales casi el 10 % se descarga al medio ambiente como efluentes acuosos después de la tinción y el procesamiento [
Los colorantes suelen tener estructuras complejas compuestas por cromóforos, responsables del color, y auxocromos. Los cromóforos más comunes son azo (─N═N─), nitro (─NO2), nitroso (─N═O), tiocarbonilo (─C═S), carbonilo (─C═O), así como estructuras aromáticas que incluyen anillos de benceno, naftaleno o antraceno, mientras que los auxocromos con grupos -NH3, -COOH, -HSO3 u -OH, determinan la intensidad del color y le confieren solubilidad en agua a la molécula [
En el estudio de los mecanismos de reacción de los procesos tipo Fenton, se han encontrado dos vías para explicar la escisión de los colorantes azoicos, mediada por radicales hidroxilos: la primera implica el ataque de HO• al cromóforo (─N═N─) y la segunda la reacción con el carbono del anillo aromático unido a un átomo de nitrógeno del grupo azo [
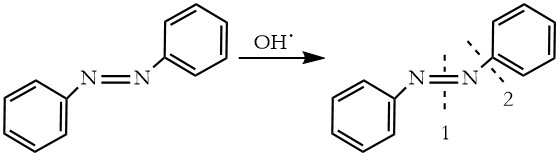
En el primer caso, la adición sucesiva de HO• al enlace (─N═N─) conduce a procesos de oxidación que generan compuestos nitroso o nitroaromáticos. Posteriormente, los grupos nitro se sustituyen por HO• para producir fenoles [
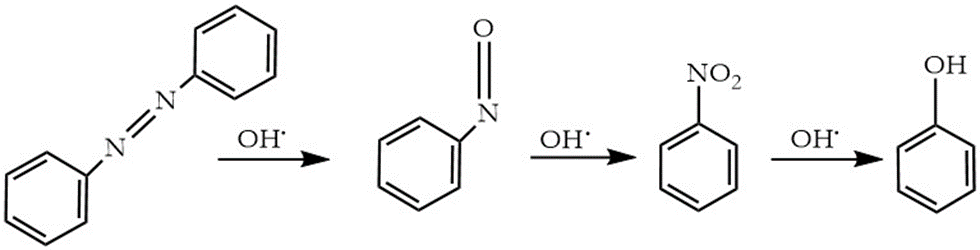
En el segundo caso, el radical HO• se une al átomo de carbono y favorece la ruptura del enlace C-N produciendo un radical fenoxi y fenildiazeno, este último compuesto puede oxidarse por varias vías para dar paso al radical fenildiazeno, el cual se rompe homolíticamente para formar el radical fenilo, que abstrae un átomo de hidrógeno del radical HO2• y se sigue oxidando para obtener productos hidroxilados [
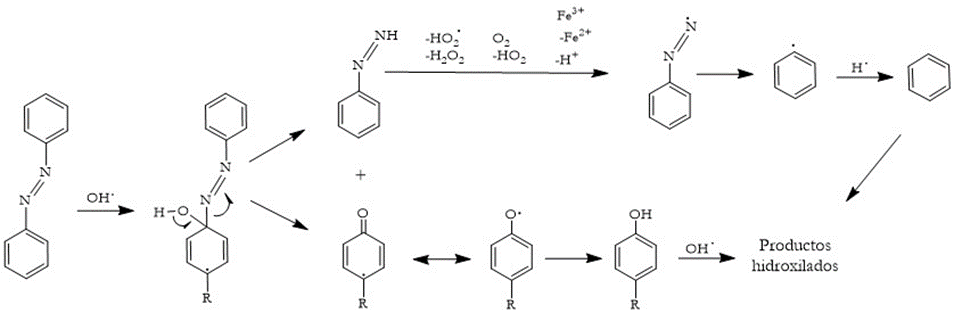
3.6.2 Fenoles
Los compuestos fenólicos y fenoles clorados son de los contaminantes ambientales más comunes, debido a su presencia generalizada en los efluentes de muchas industrias químicas, farmacéuticas, refinerías de petróleo, industrias petroquímicas y de resinas fenólicas [
Para hidrocarburos aromáticos, las reacciones proceden a través de adiciones electrofílicas de HO• sobre los anillos aromáticos, dando paso a productos hidroxilados. Estos productos hidroxilados, en presencia de radicales se pueden oxidar a quinonas, que a su vez experimentan reacciones de apertura de anillo adicionales para generar ácidos alifáticos saturados e insaturados (Figura 9). La mineralización se logra mediante la oxidación de estos ácidos alifáticos hasta CO2 y H2O [
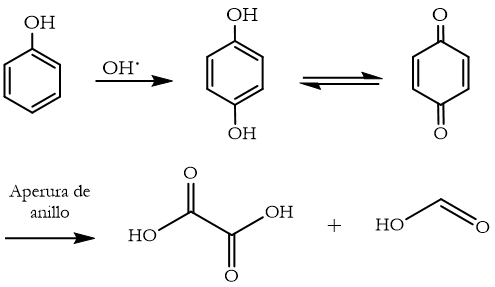
3.6.3 Plaguicidas
Los plaguicidas son sustancias químicas importantes que se utilizan ampliamente en los sistemas agrícolas para controlar o eliminar organismos indeseables como plagas, malezas, insectos, enfermedades de plantas o animales (causadas por hongos o bacterias) y así mejorar el rendimiento y la calidad de los productos agrícolas [
3.6.4 Activos farmacéuticos
El uso generalizado de productos farmacéuticos ha favorecido la entrada de residuos de éstos a las fuentes de agua debido a su eliminación incompleta [
Se ha publicado una gran variedad de investigaciones relacionadas con la aplicación de procesos tipo Fenton catalizados por óxidos de hierro, para la degradación de productos farmacéuticos. Se destacan estudios sobre la degradación de sulfonamidas [
4. CONCLUSIONES
Con el presente artículo de revisión se provee un panorama general sobre el proceso Fenton heterogéneo y la aplicación de óxidos de hierro como catalizadores para este sistema. Los sistemas tipo Fenton catalizados por óxidos de hierro constituyen una alternativa muy prometedora para el tratamiento de aguas residuales, debido al carácter benigno de estos sólidos, a sus características físicas y químicas y a la posibilidad de someterlos a modificaciones que elevan su capacidad catalítica.
Los procesos Fenton y tipo Fenton se fundamentan en la producción de especies oxidantes altamente reactivas como, el radical hidroxilo (HO•), el radical anión superóxido (O2•-) y el radical perhidroxilo (HO2•), los cuales son responsables de la degradación (oxidación total) de moléculas orgánicas contaminantes.
Magnetita (Fe3O4), hematita (α-Fe2O3), goethita (α-FeOOH) y ferrihidrita (FeOOH) son las especies sólidas de hierro (óxidos y oxihidróxidos) más estudiadas como catalizadores en reacciones tipo Fenton. Dichas especies han presentado diferentes niveles de degradación catalítica de contaminantes orgánicos, dependiendo del tipo de sustrato, del pH (por ejemplo, valores de pH entre 3 y 7), de la temperatura (favorablemente entre 20 °C y 40 °C) y de la concentración de H2O2. Sin embargo, con el objetivo de optimizar el sistema Fenton/óxidos de hierro, se han diseñado diversas estrategias para mejorar la eficiencia del ciclo catalítico Fe(III)/Fe(II): empleo de radiación UV-Vis (proceso foto-Fenton), incorporación de Fe metálico (Fe0), de metales de transición (Co, Cu y Mn), empleo de soportes catalíticos y control de la morfología de las partículas.
Múltiples aplicaciones de los óxidos y oxihidróxidos de hierro en reacciones de degradación catalítica tipo Fenton dan cuenta de la importancia de estos minerales como catalizadores heterogéneos, entre ellas la degradación oxidativa de colorantes, de compuestos fenólicos, de productos farmacéuticos y de plaguicidas.
Por otra parte, se han utilizado diferentes métodos de preparación de catalizadores (por ejemplo: precipitación, impregnación, método hidrotérmico, sol-gel, precipitación-deposición) con el fin de optimizar las características fisicoquímicas (morfología, tamaño de partícula, área superficial, estructura, control de los estados de oxidación e incorporación de otros metales) de los materiales basados en óxidos de hierro, para elevar su desempeño en las reacciones tipo Fenton.
5. AGRADECIMIENTOS
Los autores agradecen el soporte financiero al proyecto “Sólidos basados en α-Fe2O3 como catalizadores de procesos tipo Fenton”, a través del programa “Formación de talento humano de alto nivel en maestrías en el departamento de Cundinamarca” otorgado por la Fundación CeiBA junto con la Gobernación de Cundinamarca (Colombia). También agradecen el apoyo logístico y financiero de la Universidad Nacional de Colombia (Proyecto DIB 48558).
CONFLICTO DE INTERÉS
Los autores declaran que no existe ningún tipo de conflicto de intereses.
CONTRIBUCIÓN DE LOS AUTORES
Los dos autores del presente artículo realizaron contribuciones sustanciales en términos de la conceptualización, revisión de literatura, redacción y revisión final del manuscrito. Valentina Garzón: búsqueda, recopilación y clasificación de literatura científica, análisis de la información, elaboración del primer manuscrito. José G. Carriazo: conceptualización, análisis de la información, análisis de datos, revisión, reestructuración y corrección final del manuscrito.
6. REFERENCIAS
- arrow_upward [1] J. Wang and J. Tang, “Fe-based Fenton-like catalysts for water treatment: Catalytic mechanisms and applications,” J Mol Liq, vol. 332, p. 115755, Jun. 2021, https://doi.org/10.1016/j.molliq.2021.115755
- arrow_upward [2] J. A. Torres-Luna, G. I. Giraldo-Gómez, N. R. Sanabria-González, and J. G. Carriazo, “Catalytic degradation of real-textile azo-dyes in aqueous solutions by using Cu–Co/halloysite,” Bulletin of Materials Science, vol. 42, no. 4, p. 137, Apr. 2019, https://doi.org/10.1007/s12034-019-1817-1
- arrow_upward [3] S. K. Sharma, R. Sanghi, and A. Mudhoo, “Green Practices to Save Our Precious ‘Water Resource,’” in Advances in Water Treatment and Pollution Prevention, Dordrecht: Springer Netherlands, 2012, pp. 1–36. https://doi.org/10.1007/978-94-007-4204-8_1
- arrow_upward [4] G. Crini and E. Lichtfouse, “Advantages and disadvantages of techniques used for wastewater treatment,” Environ Chem Lett, vol. 17, no. 1, pp. 145–155, Mar. 2019, https://doi.org/10.1007/s10311-018-0785-9
- arrow_upward [5] R. Ameta, A. K. Chohadia, A. Jain, and P. B. Punjabi, “Fenton and Photo-Fenton Processes,” in Advanced Oxidation Processes for Waste Water Treatment, Elsevier, 2018, pp. 49–87. https://doi.org/10.1016/B978-0-12-810499-6.00003-6
- arrow_upward [6] M. Coha, G. Farinelli, A. Tiraferri, M. Minella, and D. Vione, “Advanced oxidation processes in the removal of organic substances from produced water: Potential, configurations, and research needs,” Chemical Engineering Journal, vol. 414, p. 128668, Jun. 2021, https://doi.org/10.1016/j.cej.2021.128668
- arrow_upward [7] D. Ghime and P. Ghosh, “Advanced Oxidation Processes: A Powerful Treatment Option for the Removal of Recalcitrant Organic Compounds,” in Advanced Oxidation Processes - Applications, Trends, and Prospects, IntechOpen, 2020. https://doi.org/10.5772/intechopen.90192
- arrow_upward [8] M. Faouzi et al., “Advanced oxidation processes for the treatment of wastes polluted with azoic dyes,” Electrochim Acta, vol. 52, no. 1, pp. 325–331, Oct. 2006, https://doi.org/10.1016/j.electacta.2006.05.011
- arrow_upward [9] M. Sillanpää, M. C. Ncibi, and A. Matilainen, “Advanced oxidation processes for the removal of natural organic matter from drinking water sources: A comprehensive review,” J Environ Manage, vol. 208, pp. 56–76, Feb. 2018, https://doi.org/10.1016/j.jenvman.2017.12.009
- arrow_upward [10] W. H. Glaze, J.-W. Kang, and D. H. Chapin, “The Chemistry of Water Treatment Processes Involving Ozone, Hydrogen Peroxide and Ultraviolet Radiation,” Ozone Sci Eng, vol. 9, no. 4, pp. 335–352, Sep. 1987, https://doi.org/10.1080/01919518708552148
- arrow_upward [11] D. S. Babu, V. Srivastava, P. V. Nidheesh, and M. S. Kumar, “Detoxification of water and wastewater by advanced oxidation processes,” Science of The Total Environment, vol. 696, p. 133961, Dec. 2019, https://doi.org/10.1016/j.scitotenv.2019.133961
- arrow_upward [12] H. Luo, Y. Zeng, D. He, and X. Pan, “Application of iron-based materials in heterogeneous advanced oxidation processes for wastewater treatment: A review,” Chemical Engineering Journal, vol. 407, p. 127191, Mar. 2021, https://doi.org/10.1016/j.cej.2020.127191
- arrow_upward [13] A. D. Bokare and W. Choi, “Review of iron-free Fenton-like systems for activating H2O2 in advanced oxidation processes,” J Hazard Mater, vol. 275, pp. 121–135, Jun. 2014, https://doi.org/10.1016/j.jhazmat.2014.04.054
- arrow_upward [14] I. F. Macías-Quiroga, P. A. Henao-Aguirre, A. Marín-Flórez, S. M. Arredondo-López, and N. R. Sanabria-González, “Bibliometric analysis of advanced oxidation processes (AOPs) in wastewater treatment: global and Ibero-American research trends,” Environmental Science and Pollution Research, vol. 28, no. 19, pp. 23791–23811, May 2021, https://doi.org/10.1007/s11356-020-11333-7
- arrow_upward [15] D. Kanakaraju, B. D. Glass, and M. Oelgemöller, “Advanced oxidation process-mediated removal of pharmaceuticals from water: A review,” J Environ Manage, vol. 219, pp. 189–207, Aug. 2018, https://doi.org/10.1016/j.jenvman.2018.04.103
- arrow_upward [16] Y. Deng and R. Zhao, “Advanced Oxidation Processes (AOPs) in Wastewater Treatment,” Curr Pollut Rep, vol. 1, no. 3, pp. 167–176, Sep. 2015, https://doi.org/10.1007/s40726-015-0015-z
- arrow_upward [17] A. Giwa et al., “Recent advances in advanced oxidation processes for removal of contaminants from water: A comprehensive review,” Process Safety and Environmental Protection, vol. 146, pp. 220–256, Feb. 2021, https://doi.org/10.1016/j.psep.2020.08.015
- arrow_upward [18] G. P. Anipsitakis and D. D. Dionysiou, “Radical Generation by the Interaction of Transition Metals with Common Oxidants,” Environ Sci Technol, vol. 38, no. 13, pp. 3705–3712, Jul. 2004, https://doi.org/10.1021/es035121o
- arrow_upward [19] S. Atalay and G. Ersöz, “Advanced Oxidation Processes for Removal of Dyes from Aqueous Media,” in Green Chemistry for Dyes Removal from Wastewater, Hoboken, NJ, USA: Wiley, 2015, pp. 83–117. https://doi.org/10.1002/9781118721001.ch3
- arrow_upward [20] R. M. Cornell and U. Schwertmann, The Iron Oxides: Structure, Properties, Reactions, Occurences and Use. Wiley, 2003. https://doi.org/10.1002/3527602097
- arrow_upward [21] J. D. Navratil, “Wastewater Treatment Technology Based on Iron Oxides,” in Natural Microporous Materials in Environmental Technology, Dordrecht: Springer Netherlands, 1999, pp. 417–424. https://doi.org/10.1007/978-94-011-4499-5_31
- arrow_upward [22] M. C. Pereira, L. C. A. Oliveira, and E. Murad, “Iron oxide catalysts: Fenton and Fentonlike reactions – a review,” Clay Miner, vol. 47, no. 3, pp. 285–302, Sep. 2012, https://doi.org/10.1180/claymin.2012.047.3.01
- arrow_upward [23] Q. Q. Cai, L. Jothinathan, S. H. Deng, S. L. Ong, H. Y. Ng, and J. Y. Hu, “Fenton- and ozone-based AOP processes for industrial effluent treatment,” in Advanced Oxidation Processes for Effluent Treatment Plants, Elsevier, 2021, pp. 199–254. https://doi.org/10.1016/B978-0-12-821011-6.00011-6
- arrow_upward [24] C. Lai et al., “Enhancing iron redox cycling for promoting heterogeneous Fenton performance: A review,” Science of The Total Environment, vol. 775, p. 145850, Jun. 2021, https://doi.org/10.1016/j.scitotenv.2021.145850
- arrow_upward [25] A. N. Soon and B. H. Hameed, “Heterogeneous catalytic treatment of synthetic dyes in aqueous media using Fenton and photo-assisted Fenton process,” Desalination, vol. 269, no. 1–3, pp. 1–16, Mar. 2011, https://doi.org/10.1016/j.desal.2010.11.002
- arrow_upward [26] Y. Zhu, R. Zhu, Y. Xi, J. Zhu, G. Zhu, and H. He, “Strategies for enhancing the heterogeneous Fenton catalytic reactivity: A review,” Appl Catal B, vol. 255, p. 117739, Oct. 2019, https://doi.org/10.1016/j.apcatb.2019.05.041
- arrow_upward [27] A. Babuponnusami and K. Muthukumar, “A review on Fenton and improvements to the Fenton process for wastewater treatment,” J Environ Chem Eng, vol. 2, no. 1, pp. 557–572, Mar. 2014, https://doi.org/10.1016/j.jece.2013.10.011
- arrow_upward [28] J. de Laat and H. Gallard, “Catalytic Decomposition of Hydrogen Peroxide by Fe(III) in Homogeneous Aqueous Solution: Mechanism and Kinetic Modeling,” Environ Sci Technol, vol. 33, no. 16, pp. 2726–2732, Aug. 1999, https://doi.org/10.1021/es981171v
- arrow_upward [29] H. Gallard, J. de Laat, and B. Legube, “Spectrophotometric study of the formation of iron(III)-hydroperoxy complexes in homogeneous aqueous solutions,” Water Res, vol. 33, no. 13, pp. 2929–2936, Sep. 1999, https://doi.org/10.1016/S0043-1354(99)00007-X
- arrow_upward [30] H. Gallard, J. de Laat, “Kinetic modelling of Fe(III)/H2O2 oxidation reactions in dilute aqueous solution using atrazine as a model organic compound,” Water Res, vol. 34, no. 12, pp. 3107–3116, Aug. 2000, https://doi.org/10.1016/S0043-1354(00)00074-9
- arrow_upward [31] A. Tufail, W. E. Price, M. Mohseni, B. K. Pramanik, and F. I. Hai, “A critical review of advanced oxidation processes for emerging trace organic contaminant degradation: Mechanisms, factors, degradation products, and effluent toxicity,” Journal of Water Process Engineering, vol. 40, p. 101778, Apr. 2021, https://doi.org/10.1016/j.jwpe.2020.101778
- arrow_upward [32] J. J. Pignatello, E. Oliveros, and A. MacKay, “Advanced Oxidation Processes for Organic Contaminant Destruction Based on the Fenton Reaction and Related Chemistry,” Crit Rev Environ Sci Technol, vol. 36, no. 1, pp. 1–84, Jan. 2006, https://doi.org/10.1080/10643380500326564
- arrow_upward [33] S. Rahim Pouran, A. A. Abdul Raman, and W. M. A. Wan Daud, “Review on the application of modified iron oxides as heterogeneous catalysts in Fenton reactions,” J Clean Prod, vol. 64, pp. 24–35, Feb. 2014, https://doi.org/10.1016/j.jclepro.2013.09.013
- arrow_upward [34] N. Thomas, D. D. Dionysiou, and S. C. Pillai, “Heterogeneous Fenton catalysts: A review of recent advances,” J Hazard Mater, vol. 404, part. B, p. 124082, Feb. 2021, https://doi.org/10.1016/j.jhazmat.2020.124082
- arrow_upward [35] H. Sun, G. Xie, D. He, and L. Zhang, “Ascorbic acid promoted magnetite Fenton degradation of alachlor: Mechanistic insights and kinetic modeling,” Appl Catal B, vol. 267, p. 118383, Jun. 2020, https://doi.org/10.1016/j.apcatb.2019.118383
- arrow_upward [36] L. Xu and J. Wang, “Fenton-like degradation of 2,4-dichlorophenol using Fe3O4 magnetic nanoparticles,” Appl Catal B, vol. 123–124, pp. 117–126, Jul. 2012, https://doi.org/10.1016/j.apcatb.2012.04.028
- arrow_upward [37] F. Velichkova, C. Julcour-Lebigue, B. Koumanova, and H. Delmas, “Heterogeneous Fenton oxidation of paracetamol using iron oxide (nano)particles,” J Environ Chem Eng, vol. 1, no. 4, pp. 1214–1222, Dec. 2013, https://doi.org/10.1016/j.jece.2013.09.011
- arrow_upward [38] X. Wei, X. Xie, Y. Wang, and S. Yang, “Shape-Dependent Fenton-Like Catalytic Activity of Fe3O4 Nanoparticles,” Journal of Environmental Engineering, vol. 146, no. 3, Mar. 2020, https://doi.org/10.1061/(ASCE)EE.1943-7870.0001648
- arrow_upward [39] X. Xue, K. Hanna, and N. Deng, “Fenton-like oxidation of Rhodamine B in the presence of two types of iron (II, III) oxide,” J Hazard Mater, vol. 166, no. 1, pp. 407–414, Jul. 2009, https://doi.org/10.1016/j.jhazmat.2008.11.089
- arrow_upward [40] K. Rusevova, F.-D. Kopinke, and A. Georgi, “Nano-sized magnetic iron oxides as catalysts for heterogeneous Fenton-like reactions—Influence of Fe(II)/Fe(III) ratio on catalytic performance,” J Hazard Mater, vol. 241–242, pp. 433–440, Nov. 2012, https://doi.org/10.1016/j.jhazmat.2012.09.068
- arrow_upward [41] S. Zhang, X. Zhao, H. Niu, Y. Shi, Y. Cai, and G. Jiang, “Superparamagnetic Fe3O4 nanoparticles as catalysts for the catalytic oxidation of phenolic and aniline compounds,” J Hazard Mater, vol. 167, no. 1–3, pp. 560–566, Aug. 2009, https://doi.org/10.1016/j.jhazmat.2009.01.024
- arrow_upward [42] Z.-R. Lin, X.-H. Ma, L. Zhao, and Y.-H. Dong, “Kinetics and products of PCB28 degradation through a goethite-catalyzed Fenton-like reaction,” Chemosphere, vol. 101, pp. 15–20, Apr. 2014, https://doi.org/10.1016/j.chemosphere.2013.11.063
- arrow_upward [43] Y. Wang, Y. Gao, L. Chen, and H. Zhang, “Goethite as an efficient heterogeneous Fenton catalyst for the degradation of methyl orange,” Catal Today, vol. 252, pp. 107–112, Sep. 2015, https://doi.org/10.1016/j.cattod.2015.01.012
- arrow_upward [44] Y. Li and F.-S. Zhang, “Catalytic oxidation of Methyl Orange by an amorphous FeOOH catalyst developed from a high iron-containing fly ash,” Chemical Engineering Journal, vol. 158, no. 2, pp. 148–153, Apr. 2010, https://doi.org/10.1016/j.cej.2009.12.021
- arrow_upward [45] H. Zhang, H. Fu, and D. Zhang, “Degradation of C.I. Acid Orange 7 by ultrasound enhanced heterogeneous Fenton-like process,” J Hazard Mater, vol. 172, no. 2–3, pp. 654–660, Dec. 2009, https://doi.org/10.1016/j.jhazmat.2009.07.047
- arrow_upward [46] M.-C. Lu, J.-N. Chen, and H.-H. Huang, “Role of goethite dissolution in the oxidation of 2-chlorophenol with hydrogen peroxide,” Chemosphere, vol. 46, no. 1, pp. 131–136, Jan. 2002, https://doi.org/10.1016/S0045-6535(01)00076-5
- arrow_upward [47] G. B. Ortiz de la Plata, O. M. Alfano, and A. E. Cassano, “Decomposition of 2-chlorophenol employing goethite as Fenton catalyst. I. Proposal of a feasible, combined reaction scheme of heterogeneous and homogeneous reactions,” Appl Catal B, vol. 95, no. 1–2, pp. 1–13, Mar. 2010, https://doi.org/10.1016/j.apcatb.2009.12.005
- arrow_upward [48] R. Prucek, M. Hermanek, and R. Zbořil, “An effect of iron(III) oxides crystallinity on their catalytic efficiency and applicability in phenol degradation—A competition between homogeneous and heterogeneous catalysis,” Appl Catal A Gen, vol. 366, no. 2, pp. 325–332, Sep. 2009, https://doi.org/10.1016/j.apcata.2009.07.019
- arrow_upward [49] J. Shi, Z. Ai, and L. Zhang, “Fe@Fe2O3 core-shell nanowires enhanced Fenton oxidation by accelerating the Fe(III)/Fe(II) cycles,” Water Res, vol. 59, pp. 145–153, Aug. 2014, https://doi.org/10.1016/j.watres.2014.04.015
- arrow_upward [50] X. Huang, X. Hou, J. Zhao, and L. Zhang, “Hematite facet confined ferrous ions as high efficient Fenton catalysts to degrade organic contaminants by lowering H2O2 decomposition energetic span,” Appl Catal B, vol. 181, pp. 127–137, Feb. 2016, https://doi.org/10.1016/j.apcatb.2015.06.061
- arrow_upward [51] J. He, X. Yang, B. Men, and D. Wang, “Interfacial mechanisms of heterogeneous Fenton reactions catalyzed by iron-based materials: A review,” Journal of Environmental Sciences, vol. 39, pp. 97–109, Jan. 2016, https://doi.org/10.1016/j.jes.2015.12.003
- arrow_upward [52] L. Zhao, Z.-R. Lin, X. Ma, and Y.-H. Dong, “Catalytic activity of different iron oxides: Insight from pollutant degradation and hydroxyl radical formation in heterogeneous Fenton-like systems,” Chemical Engineering Journal, vol. 352, pp. 343–351, Nov. 2018, https://doi.org/10.1016/j.cej.2018.07.035
- arrow_upward [53] W. P. Kwan and B. M. Voelker, “Rates of Hydroxyl Radical Generation and Organic Compound Oxidation in Mineral-Catalyzed Fenton-like Systems,” Environ Sci Technol, vol. 37, no. 6, pp. 1150–1158, Mar. 2003, https://doi.org/10.1021/es020874g
- arrow_upward [54] G. S. Parkinson, “Iron oxide surfaces,” Surf Sci Rep, vol. 71, no. 1, pp. 272–365, Mar. 2016, https://doi.org/10.1016/j.surfrep.2016.02.001
- arrow_upward [55] J. G. Carriazo Baños, V. E. Noval Lara, and C. Ochoa Puentes, “Magnetita (Fe3O4): Una estructura inorgánica con múltiples aplicaciones en catálisis heterogénea,” Revista Colombiana de Química, vol. 46, no. 1, p. 42, Jan. 2017, https://doi.org/10.15446/rev.colomb.quim.v46n1.62831
- arrow_upward [56] F. C. C. Moura et al., “Efficient use of Fe metal as an electron transfer agent in a heterogeneous Fenton system based on Fe0/Fe3O4 composites,” Chemosphere, vol. 60, no. 8, pp. 1118–1123, Aug. 2005, https://doi.org/10.1016/j.chemosphere.2004.12.076
- arrow_upward [57] J. Chun et al., “Magnetite/mesocellular carbon foam as a magnetically recoverable fenton catalyst for removal of phenol and arsenic,” Chemosphere, vol. 89, no. 10, pp. 1230–1237, Nov. 2012, https://doi.org/10.1016/j.chemosphere.2012.07.046
- arrow_upward [58] S. Yang et al., “Degradation of Methylene Blue by Heterogeneous Fenton Reaction Using Titanomagnetite at Neutral pH Values: Process and Affecting Factors,” Ind Eng Chem Res, vol. 48, no. 22, pp. 9915–9921, Nov. 2009, https://doi.org/10.1021/ie900666b
- arrow_upward [59] X. Huang, X. Hou, F. Song, J. Zhao, and L. Zhang, “Ascorbate Induced Facet Dependent Reductive Dissolution of Hematite Nanocrystals,” The Journal of Physical Chemistry C, vol. 121, no. 2, pp. 1113–1121, Jan. 2017, https://doi.org/10.1021/acs.jpcc.6b09281
- arrow_upward [60] P. J. Vikesland, A. M. Heathcock, R. L. Rebodos, and K. E. Makus, “Particle Size and Aggregation Effects on Magnetite Reactivity toward Carbon Tetrachloride,” Environ Sci Technol, vol. 41, no. 15, pp. 5277–5283, Aug. 2007, https://doi.org/10.1021/es062082i
- arrow_upward [61] H. Liu, T. Chen, and R. L. Frost, “An overview of the role of goethite surfaces in the environment,” Chemosphere, vol. 103, pp. 1–11, May 2014, https://doi.org/10.1016/j.chemosphere.2013.11.065
- arrow_upward [62] J. J. Wu, M. Muruganandham, J. S. Yang, and S. S. Lin, “Oxidation of DMSO on goethite catalyst in the presence of H2O2 at neutral pH,” Catal Commun, vol. 7, no. 11, pp. 901–906, Nov. 2006, https://doi.org/10.1016/j.catcom.2006.03.015
- arrow_upward [63] K. Lin, J. Ding, H. Wang, X. Huang, and J. Gan, “Goethite-mediated transformation of bisphenol A,” Chemosphere, vol. 89, no. 7, pp. 789–795, Oct. 2012, https://doi.org/10.1016/j.chemosphere.2012.04.053
- arrow_upward [64] T. R. Gordon and A. L. Marsh, “Temperature Dependence of the Oxidation of 2-Chlorophenol by Hydrogen Peroxide in the Presence of Goethite,” Catal Letters, vol. 132, no. 3–4, pp. 349–354, Aug. 2009, https://doi.org/10.1007/s10562-009-0125-6
- arrow_upward [65] C. Santhosh, A. Malathi, E. Dhaneshvar, A. Bhatnagar, A. N. Grace, and J. Madhavan, “Iron Oxide Nanomaterials for Water Purification,” in Nanoscale Materials in Water Purification, Elsevier, 2019, pp. 431–446. https://doi.org/10.1016/B978-0-12-813926-4.00022-7
- arrow_upward [66] X. Hou, X. Huang, Z. Ai, J. Zhao, and L. Zhang, “Ascorbic acid/Fe@Fe2O3: A highly efficient combined Fenton reagent to remove organic contaminants,” J Hazard Mater, vol. 310, pp. 170–178, Jun. 2016, https://doi.org/10.1016/j.jhazmat.2016.01.020
- arrow_upward [67] X. Wang, J. Wang, Z. Cui, S. Wang, and M. Cao, “Facet effect of α-Fe 2 O 3 crystals on photocatalytic performance in the photo-Fenton reaction,” RSC Adv, vol. 4, no. 65, p. 34387, Jul. 2014, https://doi.org/10.1039/C4RA03866E
- arrow_upward [68] J. Y. T. Chan, S. Y. Ang, E. Y. Ye, M. Sullivan, J. Zhang, and M. Lin, “Heterogeneous photo-Fenton reaction on hematite (α-Fe 2 O 3 ){104}, {113} and {001} surface facets,” Physical Chemistry Chemical Physics, vol. 17, no. 38, pp. 25333–25341, Aug. 2015, https://doi.org/10.1039/C5CP03332B
- arrow_upward [69] Y. Ma, S. Meng, M. Qin, H. Liu, and Y. Wei, “New insight on kinetics of catalytic decomposition of hydrogen peroxide on ferrihydrite: Based on the preparation procedures of ferrihydrite,” Journal of Physics and Chemistry of Solids, vol. 73, no. 1, pp. 30–34, Jan. 2012, https://doi.org/10.1016/j.jpcs.2011.09.015
- arrow_upward [70] J. C. Barreiro, M. D. Capelato, L. Martin-Neto, and H. C. Bruun Hansen, “Oxidative decomposition of atrazine by a Fenton-like reaction in a H2O2/ferrihydrite system,” Water Res, vol. 41, no. 1, pp. 55–62, Jan. 2007, https://doi.org/10.1016/j.watres.2006.09.016
- arrow_upward [71] R. Matta, K. Hanna, and S. Chiron, “Fenton-like oxidation of 2,4,6-trinitrotoluene using different iron minerals,” Science of The Total Environment, vol. 385, no. 1–3, pp. 242–251, Oct. 2007, https://doi.org/10.1016/j.scitotenv.2007.06.030
- arrow_upward [72] K. Hanna, T. Kone, and G. Medjahdi, “Synthesis of the mixed oxides of iron and quartz and their catalytic activities for the Fenton-like oxidation,” Catal Commun, vol. 9, no. 5, pp. 955–959, Mar. 2008, https://doi.org/10.1016/j.catcom.2007.09.035
- arrow_upward [73] X. Xue, K. Hanna, M. Abdelmoula, and N. Deng, “Adsorption and oxidation of PCP on the surface of magnetite: Kinetic experiments and spectroscopic investigations,” Appl Catal B, vol. 89, no. 3–4, pp. 432–440, Jul. 2009, https://doi.org/10.1016/j.apcatb.2008.12.024
- arrow_upward [74] H. Hassan and B. H. Hameed, “Decolorization of Acid Red 1 by heterogeneous Fenton-like reaction using Fe-ball clay catalyst,” in 2011 International Conference on Environment Science and Engineering, vol. 8, pp. 232–236, 2011, [Online]. Available: http://www.ipcbee.com/vol8/52-S20010.pdf
- arrow_upward [75] C. Ruales-Lonfat et al., “Iron oxides semiconductors are efficients for solar water disinfection: A comparison with photo-Fenton processes at neutral pH,” Appl Catal B, vol. 166–167, pp. 497–508, May 2015, https://doi.org/10.1016/j.apcatb.2014.12.007
- arrow_upward [76] H. Xiang, G. Ren, X. Yang, D. Xu, Z. Zhang, and X. Wang, “A low-cost solvent-free method to synthesize α-Fe2O3 nanoparticles with applications to degrade methyl orange in photo-fenton system,” Ecotoxicol Environ Saf, vol. 200, p. 110744, Sep. 2020, https://doi.org/10.1016/j.ecoenv.2020.110744
- arrow_upward [77] X. Chen et al., “Ag nanoparticles/hematite mesocrystals superstructure composite: a facile synthesis and enhanced heterogeneous photo-Fenton activity,” Catal Sci Technol, vol. 6, no. 12, pp. 4184–4191, Jan. 2016, https://doi.org/10.1039/C6CY00080K
- arrow_upward [78] M. Minella et al., “Photo-Fenton oxidation of phenol with magnetite as iron source,” Appl Catal B, vol. 154–155, pp. 102–109, Jul. 2014, https://doi.org/10.1016/j.apcatb.2014.02.006
- arrow_upward [79] G. Zhang, Q. Wang, W. Zhang, T. Li, Y. Yuan, and P. Wang, “Effects of organic acids and initial solution pH on photocatalytic degradation of bisphenol A (BPA) in a photo-Fenton-like process using goethite (α-FeOOH),” Photochemical & Photobiological Sciences, vol. 15, no. 8, pp. 1046–1053, Jul. 2016, https://doi.org/10.1039/C6PP00051G
- arrow_upward [80] Y. Zhang et al., “Highly dispersed titania-supported iron oxide catalysts for efficient heterogeneous photo-Fenton oxidation: Influencing factors, synergistic effects and mechanism insight,” J Colloid Interface Sci, vol. 587, pp. 467–478, Apr. 2021, https://doi.org/10.1016/j.jcis.2020.12.008
- arrow_upward [81] X. Zhang et al., “Facile synthesis of mesoporous anatase/rutile/hematite triple heterojunctions for superior heterogeneous photo-Fenton catalysis,” Appl Catal B, vol. 263, p. 118335, Apr. 2020, https://doi.org/10.1016/j.apcatb.2019.118335
- arrow_upward [82] R. C. C. Costa, F. C. C. Moura, J. D. Ardisson, J. D. Fabris, and R. M. Lago, “Highly active heterogeneous Fenton-like systems based on Fe0/Fe3O4 composites prepared by controlled reduction of iron oxides,” Appl Catal B, vol. 83, no. 1–2, pp. 131–139, Sep. 2008, https://doi.org/10.1016/j.apcatb.2008.01.039
- arrow_upward [83] R. C. C. Costa et al., “Novel active heterogeneous Fenton system based on Fe3−xMxO4 (Fe, Co, Mn, Ni): The role of M2+ species on the reactivity towards H2O2 reactions,” J Hazard Mater, vol. 129, no. 1–3, pp. 171–178, Feb. 2006, https://doi.org/10.1016/j.jhazmat.2005.08.028
- arrow_upward [84] J. Xu et al., “Large scale preparation of Cu-doped α-FeOOH nanoflowers and their photo-Fenton-like catalytic degradation of diclofenac sodium,” Chemical Engineering Journal, vol. 291, pp. 174–183, May 2016, https://doi.org/10.1016/j.cej.2016.01.059
- arrow_upward [85] I. R. Guimaraes, A. Giroto, L. C. A. Oliveira, M. C. Guerreiro, D. Q. Lima, and J. D. Fabris, “Synthesis and thermal treatment of cu-doped goethite: Oxidation of quinoline through heterogeneous fenton process,” Appl Catal B, vol. 91, no. 3–4, pp. 581–586, Sep. 2009, https://doi.org/10.1016/j.apcatb.2009.06.030
- arrow_upward [86] T. D. Nguyen, N. H. Phan, M. H. Do, and K. T. Ngo, “Magnetic Fe2MO4 (M:Fe, Mn) activated carbons: Fabrication, characterization and heterogeneous Fenton oxidation of methyl orange,” J Hazard Mater, vol. 185, no. 2–3, pp. 653–661, Jan. 2011, https://doi.org/10.1016/j.jhazmat.2010.09.068
- arrow_upward [87] N. A. Zubir, C. Yacou, J. Motuzas, X. Zhang, X. S. Zhao, and J. C. Diniz da Costa, “The sacrificial role of graphene oxide in stabilising a Fenton-like catalyst GO–Fe 3 O 4,” Chemical Communications, vol. 51, no. 45, pp. 9291–9293, Apr. 2015, https://doi.org/10.1039/C5CC02292D
- arrow_upward [88] Y. Liu, X. Zhang, J. Deng, and Y. Liu, “A novel CNTs-Fe3O4 synthetized via a ball-milling strategy as efficient fenton-like catalyst for degradation of sulfonamides,” Chemosphere, vol. 277, p. 130305, Aug. 2021, https://doi.org/10.1016/j.chemosphere.2021.130305
- arrow_upward [89] R. Zhu et al., “CNTs/ferrihydrite as a highly efficient heterogeneous Fenton catalyst for the degradation of bisphenol A: The important role of CNTs in accelerating Fe(III)/Fe(II) cycling,” Appl Catal B, vol. 270, p. 118891, Aug. 2020, https://doi.org/10.1016/j.apcatb.2020.118891
- arrow_upward [90] S. Bao et al., “Heterogeneous iron oxide nanoparticles anchored on carbon nanotubes for high-performance lithium-ion storage and fenton-like oxidation,” J Colloid Interface Sci, vol. 601, pp. 283–293, Nov. 2021, https://doi.org/10.1016/j.jcis.2021.05.137
- arrow_upward [91] T. Wang, C.-C. Yang, K. Qin, C.-W. Chen, and C.-D. Dong, “Life time enhanced Fenton-like catalyst by dispersing iron oxides in activated carbon: Preparation and reactivation through carbothermal reaction,” J Hazard Mater, vol. 406, p. 124791, Mar. 2021, https://doi.org/10.1016/j.jhazmat.2020.124791
- arrow_upward [92] Y. Gao et al., “Fe 3 O 4 Anisotropic Nanostructures in Hydrogels: Efficient Catalysts for the Rapid Removal of Organic Dyes from Wastewater,” ChemPhysChem, vol. 17, no. 13, pp. 1999–2007, Jul. 2016, https://doi.org/10.1002/cphc.201600117
- arrow_upward [93] A. M. G. Domacena, C. L. E. Aquino, and M. D. L. Balela, “Photo-Fenton Degradation of Methyl Orange Using Hematite (α-Fe2O3) of Various Morphologies,” Mater Today Proc, vol. 22, part. 2, pp. 248–254, 2020, https://doi.org/10.1016/j.matpr.2019.08.095
- arrow_upward [94] H. Liu, M. Tong, K. Zhu, H. Liu, and R. Chen, “Preparation and photo-fenton degradation activity of α-Fe2O3 nanorings obtained by adding H2PO4−, SO42−, and citric acid,” Chemical Engineering Journal, vol. 382, p. 123010, Feb. 2020, https://doi.org/10.1016/j.cej.2019.123010
- arrow_upward [95] C. Xiao, J. Li, and G. Zhang, “Synthesis of stable burger-like α-Fe2O3 catalysts: Formation mechanism and excellent photo-Fenton catalytic performance,” J Clean Prod, vol. 180, pp. 550–559, Apr. 2018, https://doi.org/10.1016/j.jclepro.2018.01.127
- arrow_upward [96] J. Wang and J. Tang, “Fe-based Fenton-like catalysts for water treatment: Preparation, characterization and modification,” Chemosphere, vol. 276, p. 130177, Aug. 2021, https://doi.org/10.1016/j.chemosphere.2021.130177
- arrow_upward [97] M. Tadic, D. Trpkov, L. Kopanja, S. Vojnovic, and M. Panjan, “Hydrothermal synthesis of hematite (α-Fe2O3) nanoparticle forms: Synthesis conditions, structure, particle shape analysis, cytotoxicity and magnetic properties,” J Alloys Compd, vol. 792, pp. 599–609, Jul. 2019, https://doi.org/10.1016/j.jallcom.2019.03.414
- arrow_upward [98] L. Qiao and M. T. Swihart, “Solution-phase synthesis of transition metal oxide nanocrystals: Morphologies, formulae, and mechanisms,” Adv Colloid Interface Sci, vol. 244, pp. 199–266, Jun. 2017, https://doi.org/10.1016/j.cis.2016.01.005
- arrow_upward [99] J. W. Geus and A. J. van Dillen, “Preparation of Supported Catalysts by Deposition-Precipitation,” in Handbook of Heterogeneous Catalysis, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2008. https://doi.org/10.1002/9783527610044.hetcat0021
- arrow_upward [100] L. C. Paredes-Quevedo, C. González-Caicedo, J. A. Torres-Luna, and J. G. Carriazo, “Removal of a Textile Azo-Dye (Basic Red 46) in Water by Efficient Adsorption on a Natural Clay,” Water Air Soil Pollut, vol. 232, no. 1, p. 4, Jan. 2021, https://doi.org/10.1007/s11270-020-04968-2
- arrow_upward [101] S. Benkhaya, S. M’ rabet, and A. el Harfi, “A review on classifications, recent synthesis and applications of textile dyes,” Inorg Chem Commun, vol. 115, p. 107891, May 2020, https://doi.org/10.1016/j.inoche.2020.107891
- arrow_upward [102] M. Sahoo, “Degradation and mineralization of organic contaminants by Fenton and photo-Fenton processes: Review of mechanisms and effects of organic and inorganic additives,” Res J Chem Environ, vol. 15, no. 2, pp. 96–112, Jun. 2011, [Online]. Available: https://www.researchgate.net/publication/279585793_Degradation_and_mineralization_of_organic_contaminants_by_Fenton_and_photo-Fenton_processes_Review_of_mechanisms_and_effects_of_organic_and_inorganic_additives
- arrow_upward [103] A. Mohamed et al., “Rapid photocatalytic degradation of phenol from water using composite nanofibers under UV,” Environ Sci Eur, vol. 32, no. 1, p. 160, Dec. 2020, https://doi.org/10.1186/s12302-020-00436-0
- arrow_upward [104] X. Tian et al., “Catalytic Degradation of Phenol and p-Nitrophenol Using Fe3O4/MWCNT Nanocomposites as Heterogeneous Fenton-Like Catalyst,” Water Air Soil Pollut, vol. 228, no. 8, p. 297, Jul. 2017, https://doi.org/10.1007/s11270-017-3485-3
- arrow_upward [105] J. Zhang, X. Zhang, and Y. Wang, “Degradation of phenol by a heterogeneous photo-Fenton process using Fe/Cu/Al catalysts,” RSC Adv, vol. 6, no. 16, pp. 13168–13176, Jan. 2016, https://doi.org/10.1039/C5RA20897A
- arrow_upward [106] J. Carriazo, E. Guélou, J. Barrault, J. M. Tatibouët, R. Molina, and S. Moreno, “Catalytic wet peroxide oxidation of phenol by pillared clays containing Al–Ce–Fe,” Water Res, vol. 39, no. 16, pp. 3891–3899, Oct. 2005, https://doi.org/10.1016/j.watres.2005.06.034
- arrow_upward [107] G. Cheng, J. Lin, J. Lu, X. Zhao, Z. Cai, and J. Fu, “Advanced Treatment of Pesticide-Containing Wastewater Using Fenton Reagent Enhanced by Microwave Electrodeless Ultraviolet,” Biomed Res Int, vol. 2015, pp. 1–8, Aug. 2015, https://doi.org/10.1155/2015/205903
- arrow_upward [108] L. Yu, X. Yang, Y. Ye, and D. Wang, “Efficient removal of atrazine in water with a Fe 3 O 4 /MWCNTs nanocomposite as a heterogeneous Fenton-like catalyst,” RSC Adv, vol. 5, no. 57, pp. 46059–46066, May. 2015, https://doi.org/10.1039/C5RA04249F
- arrow_upward [109] M. Munoz, F. J. Mora, Z. M. de Pedro, S. Alvarez-Torrellas, J. A. Casas, and J. J. Rodriguez, “Application of CWPO to the treatment of pharmaceutical emerging pollutants in different water matrices with a ferromagnetic catalyst,” J Hazard Mater, vol. 331, pp. 45–54, Jun. 2017, https://doi.org/10.1016/j.jhazmat.2017.02.017
- arrow_upward [110] N. Jaafarzadeh, B. Kakavandi, A. Takdastan, R. R. Kalantary, M. Azizi, and S. Jorfi, “Powder activated carbon/Fe 3 O 4 hybrid composite as a highly efficient heterogeneous catalyst for Fenton oxidation of tetracycline: degradation mechanism and kinetic,” RSC Adv, vol. 5, no. 103, pp. 84718–84728, Sep. 2015, https://doi.org/10.1039/C5RA17953J
- arrow_upward [111] Y. Wang, J. Liu, D. Kang, C. Wu, and Y. Wu, “Removal of pharmaceuticals and personal care products from wastewater using algae-based technologies: a review,” Rev Environ Sci Biotechnol, vol. 16, no. 4, pp. 717–735, Dec. 2017, https://doi.org/10.1007/s11157-017-9446-x
- arrow_upward [112] J. Tang and J. Wang, “Fe 3 O 4 -MWCNT Magnetic Nanocomposites as Efficient Fenton-Like Catalysts for Degradation of Sulfamethazine in Aqueous Solution,” ChemistrySelect, vol. 2, no. 33, pp. 10727–10735, Nov. 2017, https://doi.org/10.1002/slct.201702249
- arrow_upward [113] S.-P. Sun, X. Zeng, and A. T. Lemley, “Nano-magnetite catalyzed heterogeneous Fenton-like degradation of emerging contaminants carbamazepine and ibuprofen in aqueous suspensions and montmorillonite clay slurries at neutral pH,” J Mol Catal A Chem, vol. 371, pp. 94–103, May 2013, https://doi.org/10.1016/j.molcata.2013.01.027
 PDF
PDF